Seminario
Proyecto Goliat
La industria farmaceútica y
su incidencia en la prescripción de fármacos
http://wwww.edupsi.com/goliat
goliat@edupsi.com
Seminario
Proyecto Goliat
La industria farmaceútica y
su incidencia en la prescripción de fármacos
http://wwww.edupsi.com/goliat
goliat@edupsi.com
Organizado por : PsicoMundo
Dictado
por :
Dr. Carlos David Silva
Clase 1
![]()
Transferir clase en archivo
.doc de Word para Windows
Capítulo 1
Introducción
Breve historia de la industria farmacéutica.
Importancia en los países desarrollados y del tercer mundo.
Principales actores a nivel mundial.
Normas internacionales y nacionales.
Actualidad y perspectivas de cambio.
Organizaciones a favor de prescripción racional y marketing adecuado.
Cambios en la investigación: ¿Qué sabemos de los fármacos?
Relación entre los profesionales, la industria y los pacientes.
Anexos
Anexo
Fuente
Tema
1
La Nación 16.11.2000
2
La Nación 15.03.2001
3
La Nación 06.03.2001
4
Clarín 09.05.1999
5
La Nación 30.11.2000
6
MaLAM
7
Rev. Int. De Psicopatología, Psicofarmacología Y Psicoterapia
8
www.who.org
¿Por qué este seminario?
Empezaré este seminario, con un comentario muy personal. Sin embargo, es el verdadero porqué de este emprendimiento.
Como expliqué en la presentación, hasta hace 3 años tenía un contacto mínimo con los laboratorios. Me escapaba de los APM[1] intencionalmente. Me resultaba fácil, por
que en esos tiempos me dedicaba a la atención domiciliaria y no podían ubicarme. Entendía que no me aportaban nada nuevo, ya que tenía formas más seguras e independientes de informarme sobre nuevas drogas. Cuando me ubicaban en alguna reunión de equipo de alguna institución para la que trabajaba, me sorprendía que me hiciesen comentarios como “Dr. Silva, quéegusto conocerlo, sé que Ud. receta mucho nuestro producto X, tengo material para darle, etc. etc.”. Yo me preguntaba ¿Cómo sabe que receto tal producto?.Sin embargo, hace 3 años, un amigo psiquiatra experto en obtener viajes y capacitación paga de los laboratorios, me develó el misterio. Los laboratorios dispon
íaen de una base de datos con la cantidad de recetas por marca y por médico, actualizada mensualmente, a partir de una sofisticada red de información en las farmacias.Me informó también su estrategia para obtener beneficios de los laboratorios. Cuando comenzaba a recetar un nuevo producto, o cambiaba de marca por precio o calidad, se ponía en contacto con el APM
y le pedía que lo incluyaera en su lista de profesionales. Los laboratorios tienen un presupuesto asignado para promoción, y el APM, al incluir al colega (que comenzaría a recetar el producto), quedaba bien ante sus superiores, ya que supuestamente a partir de su intervención ese médico comenzaba a recetar.Una excelente estrategia para obtener beneficios sin comprometer nuestros principios. Yo estaba recetando un antidepresivo en forma regular como de primera elección. Mi amigo me contactó con el APM, y a los pocos meses tenía mi primer congreso nacional pago. El laboratorio comercializaba otros 2 productos de la línea de Sistema Nervioso Central, que yo no prescribía, uno por diferencia de precio y otro por que no era de mi elección. Pese a sugerirme que los utilizara
ce, expliqué mis razones y nunca más se habló del tema. Parecía que la estrategia funcionaba.Lo mismo hice con otros laboratorios. Yo atiendo muchas horas semanales, con pacientes de ingresos medio-altos. Esto me permite elegir con bastante libertad los tratamientos farmacológicos según la efectividad, sin tener muchas limitaciones con el precio y me colocaba en la categoría “A” para los APM, que son aquellos médicos que tienen un alto nivel de prescripción de productos que se encuentran en “promoción”. También consideran el “perfil”: peso de su opinión sobre otros psiquiatras, prestigio en la zona, si habla y lee material en inglés o en Internet, etc.
.Además aparecieron en el mercado nuevos productos psiquiátricos costosos, que permiten manejar márgenes mayores para marketing. No es casual que en el último congreso de la Asociación de Psiquiatras (
(nnNorte) A)Aamericanos en Chicago, hayan asistido la cifra record de más de 300argentinos. La mayoría invitados por laboratorios.Fue el año pasado mi primer experiencia de congreso fuera de la Argentina. Tenía 3 propuestas de laboratorios que me invitaban a es
te congreso. Me resultó muy interesante como experiencia profesional. Realicé contactos muy importantes y traje enormidad de libros, revistas y materialespara educación de pacientes. Al mismo tiempo me inscribí en numerosas fuentesgratuitasde información gratuitas de fundaciones y entidades públicas que me envían material por e-mail o por correo.oe-mail material.Pero me sorprendió sobremanera el despliegue de los laboratorios. Millones y millones de dólares tirados en cenas, almuerzos, lugares de lujo exagerado, inescrupuloso. Desde mi perspectiva tercermundista:
,inmoralmente superfluo. Como ejemplo:,un laboratorio puso durante todo el día a disposición de los psiquiatras hispanohablantesparlantesuna suite en un hotel 5 estrellas,durante todo el díacon banda de jazz tocando y comida y bebida libre como “cortesía”. ¿Qué tiene eso de científico?. ¿Qué aporta a mejorar la atención de nuestros pacientes?. ¿No podrían darnos enacambio capacitación para los psiquiatras jóvenes en su lugar de residencia?.Evidentemente saben lo que hacen. Disponen de mucho dinero, y debe servir para facilitar la prescripción de algunos colegas. Algunos no se lo cuestionan. Otros les sacan provecho. Me parece bien. Regresé muy molesto con esta situación y comencé a investigar sobre el tema.
Yo estaba convencido de que aceptar una invitación de es
te tipo, no modificaba mi hábito prescriptivo. Actualmente no estoy tan seguro. Sin embargo, me resultaba incóomodo explicarle a mi familia por quéeme habían pagado un viaje de varios miles de pesos.A veces
Lla información, a vecesmodifica conductas. En un bloque del famoso programa de entrevistas 60 minutos en EE.UU., abordaron el tema de los viajes a “conferencias” pagas en lugares exóticos. Luego de ese bloque, los laboratorios y los profesionales recapacitaron sobre la inconveniencia de estas actividades, ysedejaron de realizarlas (allá).El objetivo de este seminario es compartir parte de la información que he recogido, recibir la que ustedes me puedan aportar, cuestionarnos hasta dó
onde quiere llegar cada uno individual y grupalmente y generar iniciativas para una práctica de marketing más adecuada. Esto,puede mejorarnos como personas y como grupo profesional y humano.
Breve historia de la industria farmacéutica[2]:
Las sustancias para curar son tan antiguas
,como las primeras culturas. No obstante, la industria farmacéutica tiene una tardía aparición en la revolución industrial. Es de nuestro siglo y, en realidad, de la segunda mitad.El desarrollo de la industria química en escala a principios del siglo XX y el acopio de ciencia básica que efectuaron varios países, principalmente Alemania, preparó el terreno para un formidable desarrollo de la industria fármaco-química en los últimos años.
Si bien el desarrollo es de este siglo, a fin del siglo pasado se realizaron importantes descubrimientos (hidrato de cloral en 1869, cocaína en 1884, sulfinas en 1888) de los cuales la fenacetina en 1887 y la aspirina en 1899 fueron los más importantes. Su significación reside no sólo en que uno de ellos es líder mundial de ventas casi un siglo después, sino porque fueron diseñados a partir de conocimientos químicos.
La prescripción médica hasta principios de siglo era preparada artesanalmente a pequeña escala por farmacéuticos.
El cambio de una pequeña industria a la gran industria transnacional, fue el descubrimiento de un derivado benzoico de arsénico que curaba la sífilis: El salvasan, arsénico que salva, nombre que le dio su creador, Pau
úl Ehrlich,premio Noóbel de medicina en 1908.Este medicamento
s-veneno introduce la idea de un medicamento que puede curar atacando el agente patógeno sin dañar a la persona. Fue el creador del términode“la bala mágica”. Disparado sobre todo el cuerpo actúa solamente sobre la parte enferma. Aún hoy se sigue utilizando ese término.En 1
.935 el imperio químico alemán Farben, pone en el mercado la primera sulfamida. Fueron descubiertas cuando se realizabanrealizandoexperiencias conlassobras de colorantessobrantesdeen esa empresa química. Esta metodología de investigación -que busca usar moléculas excedentes de la industria con fines terapéuticos- continuó por muchos años. La posibilidad de buscar nuevos usos para una molécula patentada generannuevos mercados de gran rendimiento marginal. Cuando se observóLa observación del crecimiento del cabello con el uso de una droga desarrollada para bajar la tensión arterial, se empezó aycomercializarla como tónico capilar.eEs un ejemplo típico de esto (minoxil).En los años 40
,hacen su irrupción los dominadores de los siguientes veinte años: los antibióticos. En los años 60 aparecen las benzodiacepinas y el propanolol.La guerra
,fue la gran madre del desarrollo fármacoindustrial. Los países reaccionaron ante esta fuerte realidad que les causó la suspensión de la provisión de drogas por parte de Alemania. La consolidación del poderío alemán no sólo se debía a su mejor capacidad tecnológica, sino también a unahábil manejo del sistema de patentes de la época. La investigación y el desarrollo de nuevas drogas, más el apoyo de la protección patentaria, reveló en los primeros antibióticos un excelente negocio.Los nuevos descubrimientos comenzaron a ser
hacerde una rentabilidad asombrosa. Los monopolios de explotación que generaba el sistema,estimularon de una manera decisiva la investigación y el desarrollo.En pocos años se convirtió en industria líder en investigación, desarrollo, producción, comercialización, marketing y, fundamentalmente, ganancia. Entre 1963 y 1976, en términos de retorno de inversión, la industria farmacéutica aparece primera en el ranking en siete años, segunda en cuatro, tercera en dos y cuarta en uno. Los productos farmacéuticos rindieron 26 veces más que los automóviles, tres veces más que el petróleo y el doble que las editoriales. Niña mimada de Wall Street -tal como sucede en casi todo el mundo- la farmacéutica es la más rentable de las industrias de Estados Unidos.
Historia de la Psicofarmacología[3]: inicio
En el mundo primitivo, donde la enfermedad mental obedecía a concepciones animistas (pensamiento mágico), la forma de curación debía estar acorde con
alas mismas, y se utilizaban rituales practicados por médicos-brujos o shamanes con el uso de plantas medicinales con efectos psicotrópicos, sedantes y alucinógenos (tabaco, yagé, ayahuasca, coca, chamico, hongos). Adicionalmente, los indios chocoes del Urabá usaban unas jaulas rituales para encerrar a los pacientes agitados, y los Kogui usaban el método de la confesión y la purificación.Por otro lado, la medicina occidental que prevalece en nuestros días, tiene sus orígenes en la introducción del método clínico-empírico por Hipócrates, dejando de un lado las creencias mágicas. Esto permite el desarrollo de la clasificación de enfermedades y de su respectivo tratamiento. Esta concepción se ve reforzada en el Renacimiento con Johan Weyer (1515-1588), considerado el "primer psiquiatra moderno"
;por E. Kant, quien en 1798 hizo una clasificación de las enfermedades mentales, y por Félix Platter (1536-1614), quien publica el primer tratado de enfermedades mentales (Rosselli, 1968).Los métodos terapéuticos con los que se contaba hasta finales del siglo pasado eran la sujeción o restricción física, métodos de sugestión e hipnosis. La farmacología psiquiátrica se limitaba en ese entonces a hipnóticos como el paraldehido, el hidrato de cloral, bromuro de hioscina como antipsicótico, morfina para la psicosis maníaca, picrotoxina como antidepresivo.
A comienzos del siglo XX sólo se contaba con procedimientos rudimentarios, algunos de ellos con cierto grado de eficacia, pero con enormes riesgos para los
elpacientes como los comas insulínicos para el tratamiento de la esquizofrenia (Sakel, 1933), la tonoclonoterapia cardiozólica para la esquizofrenia agitada (Von Meduna, 1935), el electrochoque que reemplazó al cardiozol (Cerletti y Bini, 1938), y la psicocirugía para enfermedades mentales crónicas (Egas Monís, 1936).Después de la segunda guerra mundial, especialmente a partir de 1952 con el advenimiento de los psicofármacos, se produce una "medicalización" de la psiquiatría y se impone un enfoque más biologista, como el que conocemos en la psiquiatría actual. Se abren nuevamente las puertas de los hospitales psiquiátricos y se crean diversos programas terapéuticos como el Marlborough Program con clubes sociales de pacientes, centros de atención de día o noche y programas de rehabilitación que permiten el manejo ambulatorio de estos pacientes.
Antipsicóticos
A pesar de que las fenotiazinas habían sido desarrolladas por Bernthsen en 1883 en un intento por encontrar alternativas de preparación del azul de metileno, su aplicación clínica sólo vino a darse a comienzos del S. XX como antiséptico urinario (Van Kammen & Marder, 1995).
Los comienzos de la psicofarmacología se remontan al redescubrimiento de las fenotiazinas en 1947 por Paul Charpentier en su búsqueda de nuevos antihistamínicos y a los trabajos de Henry Laborit en 1949, un cirujano francés que intentó disminuir los efectos de la ansiedad preoperatoria
iva, el estrés quirúrgico y el shock postoperatorio con la administración de antihistamínicos (como la Prometazina) más otros fármacos, lo que él llamó un "cocktail lítico" o también "terapia de hibernación". Esta mezcla causaba hipotermia y sedación y una sensación de indiferencia y tranquilidad (ataraxia) que permitía una mayor tolerancia a las cirugías mayores. Simone Courvoiser et al. descubrieron que la Clorpromazina poseía un marcado efecto sedativo con baja toxicidad. Laborit descubrió que los pacientes tratados perioperatoriamente con Clorpromazina se encontraban muy relajados y tranquilos.Compartió su experiencia con un grupo de psiquiatras que evidenciaron un efecto calmante en pacientes agitados. Los psiquiatras Delay & Deniker fueron motivados por Laborit a utilizar la Clorpromazina en ocho pacientes psicóticos. En tres días éstos se vieron significativamente recuperados de sus alucinaciones auditivas (Pletscher, 1991). Flügel en 1953 la clasificó como neuroléptico, por su capacidad para producir efectos secundarios a nivel del SNC, pero Brooks en 1956 sugirió que los efectos terapéuticos no dependían de la disfunción extrapiramidal (Stanilla & Simpson, 1995).
Previo al descubrimiento de la Clorpromazina como antipsicótico, la Reserpina (extractada de la planta Rauwolfia Serpentia de la India, África y Sudamérica) fue el primer medicamento en ser utilizado con fines antipsicóticos. En 1931, Sen y Bose reportaron su efecto terapéutico en hipertensión y manía. Hugo Bein logró extractar la Reserpina de la planta y la comercializó justo antes de la aparición de la Clorpromazina. Pletscher et al. descubrieron en 1956 que la Reserpina tenía la capacidad de depletar en forma prolongada la serotonina cerebral, lo cual explicaba su efecto tranquilizante en la esquizofrenia. Sin embargo, los efectos depresores y el alto riesgo suicida que acompañó a su administración (10%) la condenaron al desuso relativo.
Luego de la Reserpina y la Clorpromazina aparecieron la Perfenazina y la Flufenazina y en 1957 Paul Janssen sintetizó la primera butirofenona (R1187) a partir del analgésico Norpetidina y luego el Haloperidol fue sintetizado en 1958 por Hermans. Aunque a la Metoclopramida, un derivado del antiarrítmico Procainamida, se le han asignado propiedades antipsicóticas leves, se ha utilizado como antiemético. El Sulpiride, un derivado, fue propuesto inicialmente para uso en gastroenterología, pero luego fueron descubiertas sus propiedades antipsicóticas en 1960. La Clozapina fue lanzada al mercado en 1965, pero sus efectos atípicos sólo vinieron a apreciarse en 1989; en parte por su descontinuación en 1975 debido a la incidencia de agranulocitosis en Finlandia. En 1992 es lanzada la Risperidona y en 1997 la Olanzapina (Van Kammen & Marder, 1995).
Estabilizantes del humor:
En 1800 se llevó a cabo el descubrimiento de dos nuevos minerales, petalite y spodumene, en una isla cercana a Estocolmo, en Suecia. Una pequeña parte del petalite permaneció sin identificar hasta 1817 cuando Arfwedson descubrió un nuevo álcali al que denominaron "lithion". En 1843 Alexander Ure demostró que un cálculo vesical de ácido úrico perdía peso al ser colocado en una solución carbonatada de litio. Posteriormente, Trousseau y Haig afirmaban que la manía y la depresión dependían de im
nbalances en los niveles de ácido úrico. El danés Carl Lange informó en 1886 que una mezcla que contenía litio era eficaz en la profilaxis de la depresión y su hermano Fritz, en 1894, amplió la indicación al manejo de episodios depresivos agudos. Alrededor de 1950, el australiano John Cade redescubrió el efecto antimaníaco del Litio al reportar un efecto calmante en animales de laboratorio. Esto lo animó a tratar a un paciente con una manía crónica de 5 años de evolución con recuperación completa. El paciente, sin embargo, murió debido a una intoxicación. A comienzos de los años 60, Schou dio el impulso definitivo para que el litio fuese considerado el medicamento de elección en el manejo de las crisis maníacas y en la profilaxis del trastorno afectivo bipolar (Jefferson & Greist, 1995).Antidepresivos:
A mediados de este siglo (1952) aparecieron fármacos con actividad tuberculostática in vivo como la Isoniazida, la cual se encontró casualmente en el proceso de síntesis de las semicarbazonas, también tuberculostáticas. Se sintetizaron después algunos derivados como la Iproniazida (1953) con los que se pretendía mejorar aún más el efecto antimicrobiano. En esa época Zeller et al., descubrieron que la Iproniazida era un potente inhibidor de la MAO cerebral y que tenía la capacidad de revertir la acción depresora de la Reserpina al atenuar la depleción de la serotonina cerebral. En 1954, Bloch et al. (1954) observaron que los pacientes tuberculosos tratados con Iproniazida se tornaban eufóricos y a veces exaltados, lo que les llevó a proponerlo en el manejo de pacientes con depresión. Sin embargo los resultados en estudios posteriores fueron desalentadores, posiblemente por la inclusión errónea de pacientes y la duración insuficiente del tratamiento. Se concluyó en aquél entonces que la psicoestimulación se debía más a propiedades anfetamínicas que antidepresivas. Luego, Kline et al. (1958) llevaron a cabo un estudio mejor diseñado en pacientes con depresión crónica con un promedio de 20 años de hospitalización. Al cabo de varias semanas un 70% de ellos mostró una mejoría notable. Sin embargo, este hallazgo vino a ser empañado por varios casos de necrosis hepática aguda y por la descripción del "síndrome del queso" debido al aumento de la tiramina de la dieta que provocaba crisis hipertensivas (Pletscher, 1991). En Estados Unidos y Suecia fueron raramente prescritos (más con el advenimiento de los antidepresivos tricíclicos), pero en Gran Bretaña llegaron a ser extremadamente populares, especialmente a mediados de los años 70, con el desarrollo de derivados no hidrazínicos de menor hepatotoxicidad (Pare, 1985). A partir de 1987 se inició el desarrollo de inhibidores selectivos de la MAO-A (casi sin efecto tiramínico) que han permitido la reincorporación de este tipo de medicamentos en el arsenal terapéutico de varios países europeos.
En 1889 se sintetizó lo que constituiría el núcleo de la estructura química de los ADT (antidepresivos tricí
iclicos), el Iminodibenzil; pero solamente en 1948, se evaluaron más de 40 derivados del Iminodibenzil buscando posibles efectos antihistamínicos, antiparkinsonianos, analgésicos y sedantes (Baldessarini, 1990). En 1950, Roland Kuhn, médico jefe de un hospital psiquiátrico suizo, probó un antihistamínico de la compañía Geigy con fines hipnóticos, el G22150. Esta sustancia era similar a la Clorpromazina, pero poseía muchos efectos adversos. Kuhn experimentó luego, en 1956, con el G22355 y observó que los pacientes deprimidos mejoraban significativamente (Kuhn, 1958). Este hallazgo no fue aceptado inicialmente por la comunidad médica norteamericana, pero la eficacia demostrada por estudios adicionales, la ausencia de efectos adversos fatales y el descubrimiento del rol de las monoaminas en la depresión, llevaron a su uso generalizado (Pletscher, 1991).Benzodiacepinas y nuevos fármacos:
Otros medicamentos de más reciente descubrimiento han venido ofreciendo un enorme abanico de posibilidades terapéuticas que obliga al clínico a conocer ciertos detalles de su farmacología con el fin de ofrecer la mejor alternativa a sus pacientes. El barbital fue el primer barbitúrico, introducido para la práctica clínica en 1903. En 1953 el Meprobamato remplazó a los barbitúricos como hipnótico de elección y en 1961, el Clordiazepóxido fue la primera benzodiacepina lanzada al mercado. En 1935 fue sintetizada la anfetamina y en 1937 se describieron sus propiedades paradójicas en niños con trastornos del comportamiento por Bradley. La Tacrina fue sintetizada en 1945, pero su capacidad de inhibir la acetilcolinesterasa sólo fue descubierta en 1953 y su eficacia en la demencia de tipo Alzheimer desde 1986. El Bupropión fue sintetizado en 1966 pero sólo vino a ser aprobado en 1985. La Carbamazepina (con una estructura similar a la de la Imipramina) fue aprobada inicialmente para el manejo de la neuralgia del trigémino en 1968. El Ácido Valproico fue usado inicialmente como vehículo de otras sustancias que estaban siendo evaluadas por sus propiedades anticonvulsivantes. Su uso comenzó en 1964 y sus propiedades antimaníacas se describieron desde 1966. Los ISRS fueron descubiertos a comienzos de los años 70, pero su comercialización sólo se produjo en 1988 con el lanzamiento de la Fluoxetina.
En la actualidad, la psicofarmacología ocupa cada vez más un lugar preponderante en el manejo de los pacientes con trastornos psiquiátricos por la aparición permanente de nuevos medicamentos psicotrópicos, más fruto de la ingeniería molecular
,que del descubrimiento azaroso de las propiedades de sustancias desconocidas. Contribuyen a la importancia de la psicofarmacología el desarrollo de técnicas diagnósticas que están permitiendo avanzar en el develamiento de las bases biológicas de la mayoría de los trastornos psiquiátricos y los avances en la ingeniería genética, que llevan a la creación de bancos de datos de estructuras tridimensionales como receptores, enzimas o factores de transducción de señales, que van a permitir la síntesis de sustancias cada vez más específicas. Estos avances están llevando a un cambio de actitud y hábitos terapéuticos de la mayoría de los especialistas en psiquiatría. Datos de la APA entre 1988 y 1989,muestran que un tercio de los psiquiatras en EE.UU.Aprescriben medicamentos a por lo menos un 46.7% de sus pacientes ambulatorios, otro tercio entre el 46.7% y 84.6% y el resto a más del 84.6% de sus pacientes. Este último grupo está compuesto principalmente por psiquiatras jóvenes (Thompson, 1992 ; Olfson et al., 1994).Fuentes de información:
Existen múltiples fuentes de información sobre los perfiles farmacológicos de los medicamentos, entre las que se cuentan aquellas financiadas por la industria farmacéutica (PLM en Colombia, p.ej.). Sin embargo existen otras publicaciones mucho más confiables que permiten un acercamiento idóneo al tema en cuestión. Vale la pena destacar las monografías que publica anualmente la USP-DI (The United States Pharmacopeia Dispensing Information) desde 1980 en 2 volúmenes (Drug Information for the Health Care Provider y Advice for the Patient) (USP-DI, 1997); estas son revisadas por comisiones de especialistas de la FDA. Adicionalmente, un gran número de publicaciones mensuales, bimensuales o trimestrales inundan las bibliotecas, ya sea en forma impresa o electrónica. Vale la pena destacar algunas que se caracterizan por su imparcialidad, seriedad y sobre todo, por un comité editorial de reconocido prestigio en el área de la psicofarmacología: Psychopharmacology, Psychopharmacology (Berlin), Neuropsychopharmacology, Journal of Clinical Psychopharmacology, Psychopharmacology Bulletin, European Clinical Psychopharmacology, Clinical Therapeutic Pharmacology...
Importancia DE LA INDUSTRIA FARMACÉUTICA en los países desarrollados
y del tercer mundo
inicio
El mercado farmacéutico, como otras áreas de la economía mundial, se encuentra en una etapa de profundas transformaciones. El desarrollo de medicamentos a partir del genoma humano, abrió un espacio para la investigación de patologías hasta ahora vírgenes de tratamiento y una nueva modalidad de comprender el mecanismo de acción de los fármacos y su investigación y desarrollo.
Este fue uno de los factores que llevaron a muchas empresas transnacionales a fusionarse, para hacer frente a las fuertes inversiones que requerirá este nuevo escenario y que, sin lugar a dudas, generará grandes ganancias en los años venideros. Se calcula que dos terceras partes de las 30.000 enfermedades que se conocen en la actualidad no tienen cura.
Algunos ejemplos de este fenómeno son el convenio de Roche y deCode[4] (Roche había comprado ya en 1999 la firma californiana Genentech por 4.200 millones de dólares
U$); SmithKline Beechman con Genset SA y Human Genome Sciences Inc.[5]La fusión de Glaxo - SmithKline Beechman a fines del 2000[6], con ventas por 28.000 M
U$DÓLARES y una capitalización de 192.000 MU$DÓLARES, la convirtió en la segunda megaempresa, luego que Pfizer compró a Warner-Lambert en 90.000 MU$DÓLARES, también fusionada en 2000.Según IMS, la consultora internacional que mide el consumo de fármacos en los principales mercados del mundo, la distribución de las ventas por regiones es la que se señala en la tabla 1
Ventas farma
ecéeuúticas globales por región - 2000
World Audited MarketMercado Mundial Auditado
2000 SalesVentas 2000 (US$BnBillones de dólares)% ventas globales
% variación anual*
North AmericaEE.UU.152.8
48.2%
14%
EuropeEuropa75.3
23.7
8
JapanJapón51.5
16.2
3
Latin AmericaAmérica Latina18.9
6.0
9
Asia,
AfricaÁfricaandy Australia18.7
5.9
10
TOTAL
$317.2
100%
10%
Tabla 1
Fuente: IMS[7]
Estas cifras
,son difíciles de imaginar para ciudadanos comunes comoparanosotros. Es como cuando nos hablan de la cantidad de estrellas, de sinapsis nerviosas o de la deuda externa. Podemosdecirtomar, como punto de referencia, que con los 18,9US$BnBillones de dólares de Latinoamérica, podríamos solucionar el hambre y la desnutrición en el mundo (9US$BnBillones de dólares), eliminar el analfabetismo mundial (5US$BnBillones de dólares)[8], y poner en marcha un programa global de asistencia a todos los pacientes con HIV de Sudáfrica.[9]¿En qué
ese gasta?
Clases terapéuticas líderes en ventas farmacéuticas 2000
Ranking
Audited World Therapy ClassClase terapéutica auditada mundialmenteventas 2000
ventas(US$BnBillones de dólares)% ventas globales
% variación anual*
1
AntiulcerantsAntiulcerosos17.4
5.5%
13%
2
Cholest & Triglyceride ReducersReductores de colesterol y trigliceridos15.9
5.0
21
3
AntidepressantsAntidepresivos13.4
4.2
18
4
Calcium Antagonists, PlainAntagonistas del calcio9.8
3.1
2
5
Antirheumatic Non-SteroidalsAntireumáticos no esteroideos9.5
3.0
26
6
ACE Inhibitors, PlainInhibidores ACE7.3
2.3
3
7
Cephalosporins & CombinationsCefalosporinas y combinaciones6.9
2.2
-5
8
AntipsychoticsAntipsicóticos6.0
1.9
22
9
Non-Narcotic AnalgesicsAnalgésicos no narcóticos6.0
1.9
3
10
Oral AntidiabeticsDiabetostáticos orales5.9
1.9
26
Total Leading 10 ATCs at Level 3Total 10 primeras clasesterapéuticas$98.2
31.0%
+13%
Fuente: World Review 2001 (*en dólares constantes)
La aparición de los antipsicóticos atípicos, abre un mercado prometedor en el área del sistema nervioso central. Es probable que el crecimiento se mantenga en los próximos años, no solo por la indicación principal de las psicosis esquizofré
enicas, sino también por la indicación aprobada el año pasado en bipolares, y la probable aprobación futura en demencias y trastornos de personalidad. La diferencia de más del 1000 % con respecto a las drogas tradicionales y la aparición de varias drogas similares (con el fenómeno “meetoo”), permite suponer que las empresas iniciarán importantes campañas demárketingmarketing para imponer sus productos y sus marcas, ejerciendo influencia no solocona los profesionales, sino tambiéncona los familiares de los pacientes, en quienes tienen importantes aliados a la hora de obtener recursos estatales para la obtención de las drogas.
Productos líderes en ventas 2000
Ranking
Venta de
Audited World Product SalesProductos auditados mundialmenteVentas 2000
ventas(US$BnBillones de dólares)% ventas globales
% variación anual
1
Losec/Prilosec
6.1
1.9%
9%
2
Lipitor
5.4
1.7
44%
3
Zocor
4.4
1.4
15%
4
Norvasc
3.3
1.1
15%
5
Ogastro/Prevacid
3.1
1.0
33%
6
Prozac
2.9
0.9
-1%
7
Seroxat/Paxil
2.4
0.8
20%
8
Zyprexa
2.4
0.8
30%
9
Celebrex
2.4
0.7
65%
10
Zoloft
2.2
0.7
12%
Total 10 productos líderes
$34.5
10.9%
+21%
Fuente: World Review 2001 (*en dolares constantes)
Es llamativo
,que de los diez grupos más vendidos dos sean del SNC, y que de las 10 drogas con mayor volumen de venta, 4 sean de esta categoría. En la Argentina, una benzodiacepina se encuentra entre los 4 productos líderes y el 20 % del total corresponde a psicofármacos.Sin embargo, tanto en el mundo como en la Argentina, la distribución de ese gasto no es equitativa. Tampoco es equitativa la distribución del dinero para investigación. En el 10/90 Global Forum in Health Research (OMS, Ginebra), llaman la atención sobre el “10/90”, que significa que el 10% del dinero destinado a investigación se dedica a las afecciones que afligen al 90% de la población, mientras que el otro 90% del dinero se destina al 10% de las patologías que sufre el sector de la población mundial con menores necesidades de salud y más alto status económico.[10] En el tema puntual de medicamentos, el 20% de la población más rica consume el 80% del gasto en medicamentos.
Características regionales
inicio
El proceso de fusiones se dio también en el mercado local. Luego de la fusión internacional de Pharmacia & Upjohn y Searle, localmente compraron Sintial (propiedad de Searle desde 1997) y Rontag, con una erogación estimada en no menos de 200 M
U$DÓLARES. Esto le permitió pelear por el cuarto puesto con Novartis, debajo de Roemmers, Bagó y Roche, que encabezan la lista argentina. Probablemente la cartera de productos, las plantas locales y la fuerza de venta sean los atractivos que ven las multinacionales en las empresas locales, sobre todo desde la vigencia de la Ley de Patentes.Sin embargo, las nacionales mantienen su peso en el mercado local
Ventas en la Argentina según origen del capital[11]
Latinoamérica fue presionada fuertemente para adherir al régimen de patentes. La Argentina fue el último país en hacerlo, a partir de Octubre de 2000.[12] La posibilidad de vender copias o genéricos sin pago de derechos a las empresas productoras, justifica el por
qué la Argentina es uno de los países de mayor desarrollo de productos de este tipo. Se supone que lentamente estos serán desplazados por productos originales. Uno de los aspectos centrales ante esta realidad, debe ser la certificación de labioequivalenciabioequivalencia (ver nota [13] al pié) de los productos (en México, es obligatorio). Sin embargo, en la Argentina se da el extraño caso de drogas,que son más vendidas por el fabricante de la copia que por el titular de la patente (incluso a un precio superior), lo que muestra la importancia de las campañas demárketingmarketing.La participación de la Argentina en la región es importante (del orden de los 3.425 millones de dólares anuales en facturación de laboratorios) y lo seguirá siendo, según un informe de IMS.
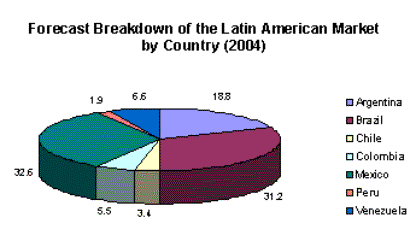
Fuente: IMS HEALTH Pharma Prognosis Latin America, 2000-2004
Otras fuentes
,mencionan que el gasto total en la Argentina es de 6.000 MU$DÓLARES del cual el 70 % es desembolso directo de los consumidores.[14] (ver mercado argentino)Además, la Argentina tiene precios relativos más altos que otros países: México, Ecuador, Chile y Colombia tienen precios medios equivalentes a un tercio de los argentinos. Esto se repite en menor medida con los precios de los países europeos. Solo EE.UU. tiene precios promedio mayores que
alos nacionales.
Las copias y genéricos,permitirían reducir sustancialmente los costos,aunque la falta de control por las autoridades sanitarias, en especial en lo referente a bioequivalencia y control de calidad (pese al notable progreso observado en la ANMAT desde el “caso propoleo”), generaliza un manto de duda sobre los productos del mercado argentino que perjudica estas iniciativas.
Resumiendo, la Argentina se encuentra entre los 12 países con mayor participación en el mercado mundial de medicamentos
,.lLos fármacos del SNC, sumados, son los de mayor presencia como categoría de una especialidad y en franco crecimiento y –probablemente- la Ley de Patentes incremente los precios y los márgenes de rentabilidad. Es razonable que en un mercado donde el 10% del costo se dedica a producción y al menos el 35% amárketingmarketing, expondrá a los médicos a fuertes presiones y variadas estrategias de venta.
Principales actores a nivel mundial
inicio
La innovación
,es fundamental para cualquier industria. Sin embargo, en la farmacéutica, éesta se constituye en el principal valor. Requiere, como vimos, de fuertes inversiones y un poco de suerte (cada vez menos). “Se estima que en el mundo hay 100 empresas con capacidad innovadora, de las que 60 operan en Europa y ninguna en la Argentina”[15]. El aumento del costo de investigación y marketing, perfila un futuro aún más monopólico que el actual.De las 15 mayores compañías farmacéuticas a nivel mundial, ocho
8son estadounidenses, dos2alemanas, dos2suizas, dos2inglesas y una1japonesa. La mayoría son empresas fármaco químicas que no se dedican sóolo a la industria farmacéutica.Sin embargo, en la Argentina, los laboratorios nacionales concentran más de la mitad de las ventas. Como mencioné con anterioridad, de los 3 laboratorios de mayor venta en el país,
2dos son de capitales nacionales (Roemmers y Bagó) (Ver La Nación Bagó). Esto puede ser explicado por la variedad de productos, la velocidad de lanzamiento de nuevos productos, estrategias de precios más flexibles, y agresivas campañas demárketingmarketing.En general, el fenómeno del predominio de la industria local se repite en los principales países. Así, Japón participa con el 80
% del mercado interno, EE.UU. con el 74%, Alemania con el 56%, etc. Los países que tienen mayor participación en el mercado externo siguen siendo los europeos (Alemania 70%, UK 84%), pese a que el porcentaje menor de EE.UU. (36%) se debe al gran volumen de su mercado interno. En la Argentina, pese al importante crecimiento de sus exportaciones,eéstas no son significativas, e incluso la apertura económica y la creación del MERCOSUR está produciendo una creciente radicación de plantas en Brasil para abastecer el mercado local. La legislación brasilera,obliga a los laboratorios extranjeros a fabricar los medicamentos localmente a partir de la ley de patentes. Sin embargo, en la mayoría de los casos, se importan los comprimidos a granel y en los países del MERCOSUR solo se fraccionan o envasan o, en el mejor de los casos, se importa la droga madre. Son escasos los ejemplos de laboratorios transnacionales que tienen plantas productoras locales, entre otras cosas porque esto facilita el pago de regalías.La escasa capacidad de producción local queda al descubierto durante las guerras. El poderío alemán puso en un grave conflicto a los países aliados durante la gran guerra
,y generó cambios en este sentido, como vimos anteriormente. Durante la Guerra de las Malvinas, quedó evidenciada la dependencia local. Algo similar sucedió cuando Eli Lilly dejó de producir insulina en el país. Probablemente, junto a la electrónica, sean las industrias que más esconden la dependencia hacia los países centrales, pese a la aparente magnitud de la producción local.
Normas internacionales y nacionales
inicio
Evidentemente, la férrea decisión del gobierno de los EE.UU. de sostener el liderazgo tecnológico de la única industria en que lo mantiene, se expresó con claridad durante los últimos años de la
osdécada de los noventa90, logrando que la totalidad de los países latinoamericanos adhieran al régimen de patentes. El Embajador en Argentina, reconocía que su misión en Argentina era “hacer lobby por los laboratorios norteamericanos y la ley de patentes”. No escatimaron amenazas y medidas ante la demora en su sanciónyque aún no cumple plenamente sus aspiraciones. (ver Clarín Digital: Recrudece la guerra por las patentes)Comenzar a hablar de comercio internacional significa entrar en una maraña de siglas difícil de entender: TRIPS (Tratado de Propiedad Intelectual), GATT (Tratado de Libre Comercio), OMC (Organización Mundial de Comercio), INPI (Instituto Nacional de Propiedad Intelectual), OEA (Organización de Estados Americanos), etc.
A pesar de los esfuerzos que hace la industria farmacéutica para hacer aparecer como sin importancia los efectos del GATT sobre los precios de los medicamentos, los expertos no dudan en expresar sus preocupaciones al respecto. El patentado
mientode los procesos y productos innovadores puede producir un desmedido incremento de los precios de los medicamentos. Aunque la Conferencia de lasnNaciones Unidas sobre el Comercio y el Desarrollo (CNUCED) afirma que la protección de la propiedad intelectual producirá efectos favorables en los países en desarrollo, no es claro cómo en estos se incrementarán las innovaciones y cóomo se asegura la transferencia de tecnología. Las innovaciones en medicamentos, tal como se ha experimentado en las últimas décadas, se han concentrado mayormente en los mercados de mayor consumo que tienen patologías diferentes a laos de los países en vías en desarrollo. Claro que los mecanismos de mercadeo han tratado - frecuentemente con éxito-– de instalar el consumo de medicamentos quenoson innecesarios o muy caros para las poblaciones de los países pobres. Tampoco se sabe cóomo se asegura la transferencia de tecnología, que la ven como un efecto de la ampliación de la protección de patentes. Lo que ocurrirá es que se intensificará el proceso de concentración de la investigación y desarrollo en los países desarrollados, dejando en los otros,lasuúltimas fases de la producción de medicamentos. O lo que es peor aún: algunos países,concentrarán la producción de medicamentos y otros solamente importarán productos terminados, tendencia que ya se está mostrando actualmente.De otro lado, los expertos de la CNUCED no dudan en mencionar los riesgos de la protección patentaria "...
es especial, precios más elevados de los productos y procesos patentados, así como restricciones en la difusión de tecnologías" . Es interesante la posición de Egipto que no concede protección patentaria a los medicamentos y su industria nativa que plantea alargar al máas largo plazo posible la adecuación de las leyes del país a los acuerdos del GATT, mientras que la industria transnacional exige la aplicación inmediata de la protección por patentes. Egipto es auto-suficiente en la producción de casi el 100 % de los medicamentos esenciales y sus autoridades son conscientes de que la aplicación del TRIPSs(Trade-Related Asspects of Intellectual Property Rights) puede provocar un aumento de los precios de los medicamentos.[16]Pero no só
olo es complicado el régimen de patentes, tema que abordaremos en una clase especial. La normativa sobre fabricación, registro, comercialización, investigación y controles de calidad y buena manufactura es una preocupación a nivel mundial, regional y nacional.La Argentina
,tiene una larga trayectoria en la regulación del mercado farmacéutico y la tecnología médica. Nuestro país,fue precursor mundial en control de equipamientos médicos tecnológicos, ya que en 1949, el Dr. Ramón Carrillo (por entonces Ministro de Salud), firmaba el decreto 25.209-49 que reglamentaba estos aspectos. En 1966,Ccuando era presidente el Dr. Illia y ministro de salud el Dr. Oñativia, se establecieron las2dos leyes básicas del contralor de medicamentos: la 16.462 y la 16.463. La primera, económica, regulaba los precios; la segunda, técnica,establecía las pautas de registro y regulación de medicamentos. La primera fue derogada por el Gral. Onganía apenas asumió, lo que generó que se dijeragaque fue un golpe de estado “con olor a remedio”.Si bien existía en la Argentina el Instituto Nacional de Alimentos, el de Farmacología y Bromatología y la Dirección Nacional de Drogas, Medicamentos y Alimentos, la creación de la ANMAT (Administración Nacional de Medicamentos, Alimentos y Tecnología Médica) en 1992, fue impulsada por el “caso propoleo”. Sin embargo, la ANMAT só
olo controla el registro a nivel nacional, pero lacirculacióncirculación interna de medicamentos es abordada por las autoridades de cada provincia, las que en muchos casos otorgan certificados provinciales. Ante la inminencia de entrada en vigencia de la Ley de Patentes, que permitía continuar la comercialización durante un período de tiempo los productos que ya tenían licencia, los laboratorios nacionales se lanzaron a la aprobación de gran cantidad de registros (más de 1000 trámites). Esto,generó que se intervinieraengala ANMAT, comprometiéndosehabiéndose comprometidolas nuevas autoridades a revisar los trámites. Sin embargo, la legislación actual es muy laxa con los medicamentos aprobados en otros países, y aún más cuando se trata de tecnología médica, donde la aprobación de la misma es automática, siempre y cuando esté documentado que se usa o está inscriptaoen el país de origen.
Actualidad y perspectivas de cambio
inicio
En estos días de mayo de 2000, nos encontramos en un momento histórico que crea un horizonte incierto pero prometedor. La lucha de los ONGs en Sudáfrica para permitir el no pago de regalías por
medicamentos para el SIDA, debido al peso que tiene esa enfermedad en el país africano, abre un antecedente muy interesante y ha instalado el debate internacional sobre la legitimidad del pago del costo de investigación por parte de países pobres, cuando esto significa la restricción al acceso a los mismos y la muerte oeinvalidez de millones de personas. (ver La nación )Indudablemente,
la necesidad dees necesario un fuerte papel regulador del estadoes necesario. Desde hace varios años, existen iniciativas internacionales para el uso racional de fármacos y el uso de genéricos[17]. Sin embargo, han quedado en general como expresiones de buena voluntad. Algunas de estas iniciativas tiene mayor peso, pero en general chocan contra la falta de compromiso de los médicos, farmacéuticos e incluso los mismos pacientes si no se ha realizado una intensa campaña de conciencitización.Si bienA pesar de que los médicos suelentienen tendencia atener en cuenta los costos en sus hábitos de prescripción, en general desconocen el costo real y las coberturas de seguros sociales de los medicamentos que prescriben.[18]Para la Argentina, es importante observar como evoluciona en este sentido su
ssocio del MERCOSUR, Brasil, que apoyado en un sistema de salud más solidario y organizado, está realizando importantes esfuerzos en este tipo de iniciativas. (ver genéricos en Brasil)Por otro lado, la generación de iniciativas internacionales para el
márketingmarketing adecuado, el uso racional de medicamentos y últimamente la medicina basada en la evidencia, se difunden tímidamente en el discurso local, generando esperanzas de cambio. Este seminario es una acción en este sentido.
Organizaciones a favor de prescripción
racional y marketing adecuado
inicio
En Perú, en 1995, en ocasión del Día del Padre, la compañía Parke-Davis ofrecía a los farmacéuticos una botella de vino de obsequio por cada pedido de tres cajas de Sinutab, un remedio para la tos y el resfrío. Un año después, otra compañía, Perufarma, ofrecía premios de rifa tales como televisores y mobiliario de cocina
,y comedor a los empleados de farmacia. (Revista del Sur 80 - Laboratorios - Chetley.htm).Muchos estudios han documentado la influencia ejercida por el marketing de la industria sobre los médicos. "No hay duda de que la mayor influencia sobre los que prescriben es ejercida por las promociones de la industria farmacéutica,” dice Richard Day, profesor de farmacología clínica de
enla Universidad de NSW que durante mucho tiempo ha abogado por la necesidad de mejorar el uso de los medicamentos. Pensemos que si aceptamos que en laaArgentina se invierte el 30% del presupuesto de los laboratorios enmárketingmarketing, estamos hablando de 1.000 millones de dólares. Hace falta mucho esfuerzo personal e institucional para contrarrestarlo.Peter Mansfield es un médico clínico de Adelaide (capital de Australia Meridional), que cobró mala fama dentro de la industria farmacéutica como la pequeña espina molesta clavada en el pié. Cuando hace catorce años se indignó al saber que una empresa multinacional estaba promocionando esteroides anabólicos para los niños pobres y famélicos de Bangladesh, sabiendo que lo que necesitaban era una mejor nutrición, fundó el Medical Lobby for Appropriate Marketing (MaLAM). Poseen un boletín bimensual, que citaremos frecuentemente a lo largo de este seminario.
MaLAM se dedica entre otras cosas a reclamar a los laboratorios cuando realizan publicidad inadecuada. (Ver publicidad en Centroamérica)
Otras organizaciones internacionales son la AIS (Acción Internacional para la Salud) con sede en Perú, o GAPUMED en la Argentina, con sede en La Plata, en la Fundación Femeba.
Buscando en la red, también me he encontrado con numerosas “perlas”, como es el artículo que denuncia la influencia de la industria en el resultado postmarketing independiente sobre los dos principales antidepresivos. (ver Tejemanejes)
Oficialmente, podemos tomar las recomendaciones de la OMS como el marco mínimo al que se deberían atener todos los países. (ver recomendaciones OMS) Les sugiero leer ese material, imprimirlo y aplicarlo a los folletos y publicidad
esque les entreguen los APM.
Cambios en la investigación:
¿Qué sabemos de los fármacos?
inicio
Se ha publicado que, en ciertas ocasiones, los médicos con relaciones económicas con compañías farmacéuticas han sido menos propensos a criticar la seguridad o eficacia de ciertos medicamentos, así como se ha publicado también cierta asociación, estadísticamente significativa, entre resultados positivos en ensayos en medicina interna y financiación del propio fabricante
manufacturador..Con el fin de investigar la objetividad de los datos farmacoeconómicos obtenidos por la industria farmacéutica, se realizó un trabajo[19] en el que se evalúan los estudios de este tipo, aparecidos en tres áreas en oncología: factores estimulantes de crecimiento de colonias, antieméticos antagonistas de serotonina y taxanos.
Se trató de dar respuesta a las siguientes preguntas: ¿son los estudios económicos financiados por la industria farmacéutica más propensos que los no financiados, a reportar las conclusiones cualitativamente favorables y menos propensos a reportar las cualitativamente desfavorables? Y ¿son los estudios financiados por la industria más propensos que los no financiados, a constatar conclusiones cualitativamente favorables a pesar de que los resultados cuantitativos sean neutrales o desfavorables?
Para tal fin, se realizó una búsqueda bibliográfica y se investigó fundamentalmente la información relativa a las conclusiones cualitativas, resultados numéricos cuantitativos, tiempo en el que se realizó el estudio, y fuente de financiación, realizando posteriormente un estudio estadístico de las relaciones entre ellos utilizando los tests de Fisher y Pearson. Un valor de p menor de 0,05 se consideró como estadísticamente significativo.
Los autores concluyen que se observó una relación (p = 0,
04) entre fuente de financiación y conclusiones cualitativas: se observa un 38% de conclusiones desfavorables en estudios no financiados y sólo 5% en estudios financiados por la industria (Tabla 2). Además, los estudios financiados por la industria fueron algo más proclives que los no financiados a sobreestimar los resultados cuantitativos, por ejemplo, ofrecer conclusiones cualitativamente favorables cuando los resultados cuantitativos fueron neutrales o desfavorables, o establecer una conclusión neutral cuando los resultados cuantitativos habían sido desfavorables, si bien en este caso la diferencia no fue estadísticamente significativa (30% frente a 13%, p = 0,26).Se han establecido varias hipótesis que ayuda
en a explicar estos hallazgos. Primero, el método retrospectivo que se ha usado en el 89% de los estudios investigados es más propensopara que sehubieranseleccionarandolos ensayos que originarían mejores resultados, para realizar posteriormente su análisis económico. Segundo, hay una tendencia evidente en la investigación farmacoeconómica, así como en otras áreas de la investigación médica, hacia la publicación de estudios con resultados positivos, en detrimento de los que ofrecen resultados negativos. Tercero, se podrían producir influencias indirectas de las compañías farmacéuticas hacia los investigadores, dado que éstos pueden recibir emolumentos, directa o indirectamente. Y cuarto, la compañía podría influir en la elaboración de los protocolos o en los criterios de evaluación económica.
Nro. de Estudios financiados por la IF
Nro. de Estudios no financiados por la IF
Estudio no financiado por la IFp
Medicamentos
1. Fact. Est. Crec. Col.
1. Antieméticos
1. Taxanos
65
25
10
63
25
13
Conclusión
favorable
neutral
desfavorable
60
35
5
42
21
38
0.04
Sobre
estimación de resultados30
13
0.26
Tabla 2
A pesar de las limitaciones que los autores indican en la realización del estudio realizado, indican que la industria es una fuente fundamental de información en muchas áreas médicas, así como que es la fuente primaria para los estudios farmacoeconómicos. Para mejorar la credibilidad de dichos análisis económicos deberían promoverse políticas en favor de la transparencia total de los intereses económicos. Igualmente deberían conducirse más análisis farmacoeconómicos de tipo prospectivo, simultáneamente con los ensayos en fase 3, lo que aumentaría la credibilidad, al eliminar la oportunidad de financiación selectiva basada en resultados clínicos.
En la Argentina, el reciente caso de una investigación donde la muerte de 13 pacientes puso al descubierto la falta de consentimiento informado para participar en el estudio (de los 137 pacientes que participaron, 80 no habí
ian dado su consentimiento), ha generado en la población general un razonable malestar ante estas iniciativas. Más recientemente, a mediados de febrero, los medios se ocuparon intensamente de investigaciones que se realizan en países pobres de Latinoamérica en niños con deficiencias respiratorias graves, a la mitad de los cuales no se los medica (se les da placebo) y probablemente morirán. Como de todas maneras no tienen acceso a esosamedicamentos alternativos por su altoelpreciode los mismos, pueden realizarse investigaciones que nopuedenserían aprobadas por los comités de ética en los países de origen.Algo peor aún ha sido dado a luz
recientementesobre la realización de un estudio en Alabama, EE.UU., entre 1939 y 1972, titulado “Sífilis terciaria en varones de raza negra”en el que se dejó libradosaa la evolución natural a 400 ciudadanos negros de muy bajos recursos, a los que se les ofrecióa“tratamiento” para la sífilis y debieronndotrasladarse a Tuskegee, en ese estado. En realidad, pese a existir un tratamiento (penicilina, desde 1945) que podría haberles curado la enfermedad, no se lesdiobrindó ningún tratamiento hasta que en 1972 el New York Times denunció la situación. La investigación consistía en ver como evolucionaba la sífilis sin tratamiento. Sóolo 8 sobrevivieron. Eso síi, Bill Clinton les pidió perdón en nombre de los Estados Unidos.En los últimos años, han proliferado consultoras que se encargan de diseñar, realizar, informar e incluso presentar los resultados para solicitar la aprobación final de nuevos fármacos. Las empresas farmacéuticas dejaron a sus tradicionales investigadores en Universidades para utilizar estas consultoras, mucho más ágiles, que contratan profesionales con capacidad de investigar y, fundamentalmente, conseguir pacientes a cambio de medicación hasta que ésta
la mismasea aprobada. Cada paciente ingresado al protocolo significande 3 a 5 mil dólares para la institución o el profesional. En Europa o EE.UU., donde se accede a la medicación por medio de la seguridad social o seguros es difícil conseguir pacientes que acepten tratamientos contra placebo. Esto ha convertido a la Argentina, con buenos investigadores pero mal pagos y caudal de pacientes, en uno de los “proveedores” para estudios en fases II y III.
Relación entre los profesionales,
la industria y los pacientes
inicio
La OMS sugirió un conjunto de directrices modelo a las que llamó Criterios Éticos para la Promoción de Drogas Medicinales. Su mensaje central es que sean los gobiernos y las autoridades de la salud las que fijen las políticas para el uso de medicamentos, y no la industria farmacéutica. No obstante, en un estudio reciente llevado a cabo en Tailandia, Australia, Vietnam, Laos, Sri Lanka e Indonesia, se encontró que había una reglamentación inadecuada de la promoción de parte de los gobiernos, y muy poca conciencia de criterios, reglamentaciones o códigos entre los trabajadores de la salud.
Anne Loes van Staa,
esantropóloga médica de Filipinas, dice.: "Cuando se acepta un obsequio, quien lo recibe queda de alguna manera sometido a una especie de deuda de gratitud, que asegura que la deuda terminará siendo pagada. Esta es la clave del éxito en la comercialización de productos farmacéuticos". [20]Claude C. Hopkins, uno de los padres de la publicidad moderna, escribió en su biografía:
" Siempre me esfuerzo por agradar y logro que mis beneficios pasen inadvertidos. He aplicado el mismo principio en la publicidad. Nunca le pido a la gente que compre. Rara vez doy precios. Ofrezco servicios, tal vez una muestra gratis. Suena
naltruista. No son cosas que hace la gente egoísta.”“En la actualidad, esta teoría se utiliza para la venta puerta a puerta. Los que venden limpiadores
,ofrecen una demostración gratis; los que venden café, un envase pequeño para probarlo. Siempre son bienvenidos. El ama de casa es toda atenciones y sonrisas. Luego, como reacción natural, se esfuerza en encontrar la forma de devolver la cortesía, comprando."
En 1992, Orlowski y Wateska, les preguntaron a 10 médicos clínicos de Cleveland si
ícreían que el hecho de aceptar viajes con gastos pagos a atractivos centros turísticos, para asistir a simposios sobre dos drogas, patrocinados por la industria (farmacéutica), influiría sobre ellos. Las respuestas de los clínicos se presentan en la tabla 1.Tabla 1
Respuesta de los clínicos sobre los efectos de obsequios
sobre sus patrones de prescripción
No influye
No cree que influya
Puede influir
Droga A
9
1
0
Droga B
8
1
1
Sin embargo, esto no fue así, como se ve en la tabla 2.
Tabla 2
Prescripción antes y después de recibir el obsequio
Antes
(promedio de recetas mensuales)
Después
(promedio de recetas mensuales)
p
Droga A
81
272
<0,001
Droga B
34
87
<0,001
En este estudio, el incremento significativo de la prescripción comenzó después de ser invitados al simposio mencionado.
En mayo de 1998, La empresa MS&D (Australia) fue franca en cuanto a las expectativas de reciprocidad. En una carta a los médicos australianos, que se refería al mayor precio de las drogas de
enMS&D Australia, el director escribía:" Tenemos como prioridad ofrecer programas de educación médica de gran calidad . Iniciativas como el “programa de cuidado de la salud MS&D”, el programa universitario, la fundación de educación en salud rural y la enseñanza universitaria para médicos generales, son prueba de nuestro compromiso…”
“… creemos que todo australiano tiene el derecho a servicios de salud de calidad tanto ahora como en el futuro. Les pedimos que nos apoyen recetando productos MS&D, así podremos continuar trabajando juntos para lograrlo.”
Pensemos cómo se sentirán nuestros pacientes al pagar más sus medicamentos por los costos de los regalos y servicios que las compañías dan a sus médicos, ya que el efecto de esos regalos es una influencia que puede no beneficiar a los pacientes.
En un artículo escrito por Melissa Sweet, una de las periodistas médicas más respetadas de Australia, y publicado
aen el Sydney Morning Herald el 25 de octubre de 1997, se menciona lo siguiente:El público, aún muchos médicos, no se dan cuenta hasta qué punto son usados los medios para promocionar los objetivos de la industria. En líneas generales, la meta de los medios –vender diarios o ganar ratings– coincide con la de la industria. Las historias de logros importantísimos (“break-through”) se repiten en ambos productos hasta el cansancio. Los informes de los medios, no sólo estimulan a los consumidores para que pregunten a sus doctores acerca de nuevos tratamientos, sino que muchos estudios han demostrado que éstos también influyen sobre los doctores.
Como consultor de relaciones públicas especializado en el cuidado de la salud, Martin Palin es experto en satisfacer la necesidad de “noticias” que tienen sus contactos mediáticos. El paquete clásico incluye investigación que se da a conocer en una conferencia o en un día dedicado a tomar conciencia de una enfermedad (disease awareness day), un experto en medicina para agregar credibilidad, y un paciente que va a aportar el ángulo de interés humano.
Describiéndose a sí mismo como “estudioso de los medios”, Palin dice: “Al final del día, si conseguiste el paquete, estás en carrera”. No es necesario que el paquete mencione un producto particular para beneficiar a su cliente, con sólo despertar una mayor conciencia de un problema, se puede aumentar el número de personas diagnosticadas y tratadas.
Si un diario menciona el problema general, digamos, el impacto de la depresión, Palin usará esa cobertura como palanca para enviar a su experto a un programa de radio en vivo, en el que los nombres de los productos son más fácilmente mencionados. “Una de mis estrategias es dar a los diarios una exclusividad”, dice Palin. “Los diarios son increíblemente influyentes en conducir cobertura electrónica”.
La industria tiene numerosas e
xstrategias de RR.PP.; muchos de los awareness days and weeks para diversas enfermedades han sido apoyadaos por laboratorios. Un ejemplo clásico es la Migraña Awareness Week, financiada por Glaxo Wellcome, pero llevada a cabo con los auspicios de la Migraine Foundation.Otra estrategia popular es comisionar una investigación cuyos resultados puedan usarse para generar cobertura mediática. O traer “prominentes expertos extranjeros” para que den entrevistas en los medios junto con reuniones de profesionales de la salud.
La industria también ha apoyado muchos grupos de pacientes – que resultan mucho más convincentes para presentar una droga que el propio fabricante – así como también la creación de grupos de consulta. También se puede reunir un grupo de especialistas, y sus conclusiones enviadas a los medios.
El Viral Hepatitis Prevention Board, que realizó presentaciones de noticias para promocionar la vacunación contra la hepatitis B, es financiado principalmente por el fabricante de la vacuna, SmithKline Beecham.
También se apunta a los periodistas individuales; muchos escritores de artículos médicos
(entre los que me incluyo)han asistido aatendidoconferencias en el exterior solventadas por los laboratorios.Muchas de las campañas de la industria coinciden con objetivos de salud pública. No muchos discutirían sobre las metas de la Influenza Awareness Week, que presenta paquetes mediáticos bajo los logos de la Australian Medical Association y del Royal Australian College of General Practitioners. Promociona la vacunación an
nual para grupos de alto riesgo, lo que reduce la mortandad y el ingreso a hospitales. Pero la cobertura de los medios rara vez menciona que la semana es financiada por los fabricantes. El principal vocero de la campaña, Alan Hampson, siempre es mencionado como director diputado de un centro colaborador de la Organización Mundial de la Salud que investiga y estudia la gripe. Pero es también empleado del fabricante CSL.En Argentina hemos visto en los últimos tiempos campañas de este tipo para obesidad, osteoporosis, demencia, depresión, psicosis, fobia, tabaquismo, etc.
etc.La Australian Medical Association y el Royal Australian College of Physicians han adoptado códigos de ética que desalientan el hecho de que los médicos acepten regalos, y el Royal Australian College de GPs está desarrollando pautas. Fiona Woodard, secretaria del subcomité de códigos de conducta de la APMA, dice que el código ha sido significativamente ajustado; se pueden dar regalos sólo cuando son recordatorios de nombres comerciales o parte de la educación médica, y que toda hospitalidad dada a los médicos debe ser de importancia menor que el componente educacional.
Los investigadores canadienses identificaron recientemente 20 artículos publicados y varios sin publicar, pidiendo demostrar los beneficios de un nuevo medicamento antipsicótico, risperidone, que se anunciaba como un importante hito en el tratamiento de la esquizofrenia. Sin embargo, después de largas investigaciones llegaron a la conclusión de que sólo se habían realizado dos pruebas grandes y siete pequeñas – pero los resultados se habían informado varias veces, a menudo simulando deliberadamente que eran resultados previamente publicados en algún otro lugar bajo el nombre de otros autores. Los investigadores no identificaron a los responsables de este subterfugio, pero llegaron a la conclusión de que tales prácticas "han comenzado a subvertir el rol de las publicaciones médicas, yendo de la información imparcial y objetiva de datos a la diseminación de información que lleva en sí misma una agenda personal o corporativa "[21].
El Journal de la American Medical Association informa que una investigación realizada hace varios años por el Senado de los Estados Unidos,
hace varios añosencontró que había compañías que invitaban a los médicos y a sus esposas a hacer viajes, con todos los gastos pagos, a lugares exóticos, incluyendo Acapulco y MonteCarlo; y ofrecían a los médicos$US$ 1.200 para que prescribieran un antibiótico a 20 pacientes en un “estudio clínico”; premiando con puntaje de frecuencia de vuelo por cada receta escrita; ofrecientdo al médico$US$100 para que leyera folletos de la compañía que fomentaba la prescripción de medicamentos altamente tóxicos para un uso no aprobado por la Food and Drug Administration[22]En Junio de 1992,
Lla Asociación Médica Americana, publicó en JAMA las siguientes recomendacionesen Junio de 1992en base al informe "Gifts to Physicians from Industry," adoptado en Diciembre de 1990; (JAMA. 1991; 265: 501 y Food and Drug Law Journal.1992; 47: 445-458); Actualizado en Junio de 1996 y Junio 1998.Muchos obsequios que los médicos reciben de empresas relacionadas con la industria farmacéutica, material y equipamiento médicos,
sirvenposeen una función importante y beneficiosa desde el punto de vista social. Por ejemplo, las empresas siempre han aportado fondos para seminarios y conferencias educativas. Sin embargo, existe una reciente preocupación con respecto a ciertos obsequios que la industria ofrece a los médicos. Algunos de ellos, que reflejan una práctica habitual, no condicen con los Principios Éticos de la Medicina. A fin de evitar la aceptación de regalos inapropiados, los médicos deberán observar las siguientes pautas:1) Todo obsequio recibido en forma individual deberá comportar, en primer lugar, un beneficio para los pacientes y ser de poco valor. En consecuencia, los textos, las comidas modestas y otros regalos, son apropiados si cumplen una genuina función educativa. No deben aceptarse pagos en efectivo. El uso de muestras medicinales para uso personal o familiar está permitido, siempre que estas prácticas no interfieran con el acceso de los pacientes a las mismas. No es aceptable que los médicos en actividad soliciten medicamentos gratuitos para uso personal o de su familia.
2) Se permiten los obsequios individuales de valor mínimo, siempre que estén relacionados con la actividad médica. (por ej. lapiceras y anotadores).
3) El Consejo de Asuntos Éticos y Judiciales define como “conferencia” o “encuentro” legítimo toda actividad que se lleve a cabo en un lugar apropiado, donde
a. la reunión esté dedicada principalmente, tanto en tiempo como en esfuerzo, a promover actividades y disertaciones científicas y educacionales objetivas (una o más presentaciones educativas deberán ser lo más destacado del encuentro) y,
b. el principal objetivo de reunir a los participantes deberá ser aumentar su conocimiento del tópico o los tópicos presentados. Deberán exponerse los aportes financieros o conflictos de intereses.
4) Los subsidios que financien los costos de las conferencias de educación médica continuada o encuentros profesionales, y que pueda
en contribuir a mejorar la atención a los pacientes, y, por lo tanto,son aceptables. Dado que la entrega de un subsidio en forma directa a un médico por parte del representante de una empresa puede crear una relación que podría influir en el uso de sus productos, todo subsidio deberá ser aceptado por el auspiciante de la conferencia, quien, a su vez, podrá usar ese dinero para reducir los gastos de inscripción de la conferencia. Los médicos participantes de la conferencia no podrán aceptar directamente de una empresa, pagos para sufragar los costos de la misma.5) No deberán aceptarse en forma directa o indirecta subsidios por parte de la industria para solventar gastos de viaje, alojamiento u otros gastos personales de los médicos participantes a conferencias o encuentros. Tampoco deberán aceptarse subsidios para compensar el tiempo de los médicos.
6) No deberán aceptarse subsidios por recepción que sobrepasen comidas modestas o eventos sociales que tengan lugar como parte de una conferencia o encuentro. Los disertantes de las conferencias o encuentros pueden aceptar honorarios y reintegro por gastos de viaje, alojamiento y comidas siempre que sean razonables.
7) También es apropiado que los consultores que brinden servicios genuinos reciban retribución razonable y acepten reembolsos por gastos de viaje, alojamiento y comida adecuados. No se deberá apelar a convenios de consultas ni asesoramiento gratuitos para justificar la retribución a los médicos por sus gastos de viaje, alojamiento y otros gastos menores.
8) Pueden permitirse becas u otros fondos especiales para que los estudiantes de medicina, residentes y docentes, puedan asistir a conferencias educativas cuidadosamente seleccionadas, siempre que la selección de quienes reciban los fondos la realice una institución académica o de capacitación.
9) Las conferencias educativas cuidadosamente seleccionadas se definen generalmente como los principales encuentros educativos, científicos o normativos de asociaciones médicas, nacionales, regionales o de especialidades.
No deberán aceptarse obsequios si ello implica un compromiso. Por ejemplo, los médicos no pueden aceptar obsequios si son ofrecidos en relación con sus prácticas de prescripción. Además, cuando las empresas financien conferencias y disertaciones médicas de terceros, la responsabilidad y el control sobre la selección del contenido, disertantes, métodos
dicosy materiales educativosy materialesestarán a cargo de los organizadores de dichas conferencias o disertaciones
Anexo 1
nota Bagó aterriza en el sudeste asiático
sección Economía
fecha de publicación 16.11.2000
autor Por Juan Aznarez De la Redacción de La Nación
Bagó aterriza en el sudeste asiático
Ya exporta a China, Corea e Indonesia
Bagó, el segundo mayor laboratorio del país de capital argentino, puso en marcha un ambicioso programa de exportaciones para posicionarse en el sudeste asiático, donde al término de este año ya habrá vendido antibióticos y antiinflamatorios por casi 13 millones de dólares.La compañía, creada en 1934 por Sebastián Bagó, se inició en el comercio internacional en la década del 70, cuando comenzó a despachar medicamentos hacia los países limítrofes, y en la actualidad cuenta con 17 filiales establecidas en toda América latina. Pero en esta instancia, con su operación regional consolidada, ha comenzado a concentrar su atención en Asia.
Por lo pronto, acaba de cerrar acuerdos con el laboratorio coreano Kun Wha Farmaceuticals por un monto de 7,5 millones de dólares. Bagó mandará sus antibióticos listos para distribuir, mientras que los antiinflamatorios se enviarán a granel, para que los envase su partner oriental.
Otros contratos firmados en los últimos días involucran a empresas de China e Indonesia, que ya han solicitado productos por tres y dos millones de dólares, respectivamente.
El director de Relaciones Institucionales de Bagó, Carlos Chaves del Valle, sostuvo que "la industria farmacéutica argentina de origen local deberá reposicionarse con nuevas estrategias de crecimiento para no perder protagonismo", tras el ingreso en vigor de la ley de patentes. Y dice que la compañía eligió profundizar su penetración en los mercados externos, que hoy le aportan 20 millones de dólares por año. Esta suma equivale al 10 por ciento de su facturación y no contemplan los productos fabricados en el exterior por sus filiales.
En esa dirección, están próximos a establecer nuevos acuerdos con India, aunque la mayor expectativa está puesta en China, país con el que realizaron sus primeros acercamientos diez años atrás.
De aquí a julio del próximo año, colocarán en el sudeste asiático 16.500 kilogramos de medicamentos y tienen en estudio un proyecto para construir una planta en ese continente, que les permitirá abastecer la demanda in situ.
Otras plazas
Además, Bagó tiene a Africa en la mira: las plazas elegidas para el aterrizaje son Sudáfrica y Nigeria, donde ya han comenzado a enviar muestras para que sean evaluadas.
El círculo de su política de salir a vender más allá del Atlántico y el Pacífico se cierra con el inicio de los despachos a Turquía, que se incrementarán en 2001.
La presencia en todas estas plazas también implican el otorgamiento de licencias para que productos desarrollados y patentados en la Argentina comiencen a ser fabricados por terceros.
Bagó es una de las tres compañías argentinas que han incluido al mercado asiático en el mapa de sus objetivos. Las otras dos que trabajan en la misma dirección son Bio Sidus e Instituto Massone, que se especializa en derivados de glándulas procesados con fines terapéuticos.
En América latina, los países que más demandan los productos de Bagó son Brasil, México, Colombia, Chile, Ecuador, República Dominicana y Panamá.
Anexo 2
nota Los panelistas El mercado argentino
sección General
fecha de publicación 15.03.2001
autor Fuentes: La Nación, Close Up y Asociación Economía de la Salud.
Los panelistas El mercado argentino
Rafael A. Storto. Carlos Chiale. Ginés González García.
Rafael A. Storto Colegio de Farmacéuticos bonaerense"La cuestión fundamental sigue siendo la salud de la población. Y la única garantía para la gente es comprar en las farmacias que estén dentro de la cadena legal de distribución."
Carlos Chiale Director del Iname
"La verdadera solución sería que se tipifique el delito y, además, que todos, desde los fabricantes hasta los consumidores, tomen conciencia del problema."
Ginés González García Rector de la Fundación Isalud
"Si alguna clínica o algún sanatorio compra esos remedios, está contribuyendo a blanquear el producto robado, y reinsertándolo en el mercado legal de los medicamentos."
El mercado argentino
El mercado farmacológico argentino elabora 7500 productos por año.
Las cinco droguerías mayoristas más importantes concentran el 40% de la distribución de los medicamentos.
El público accede a ellos a través de 12 mil farmacias en todo el país.
Un argentino gasta un promedio de 111 pesos anuales en remedios.
Se compran unos 11 medicamentos per cápita por año.
El precio promedio es de 9,80 pesos, hace diez años no llegaba a los 3.
Los medicamentos más caros son los oncológicos y los dedicados a combatir el sida.
Los más vendidos son Amoxidal, Lotrial, Lexotanil y la Bayaspirina, que vende cerca de 20 millones de unidades por año.
El 20,2% de los remedios está destinado a curar el aparato digestivo y el metabolismo.
El 18,1% son para el sistema nervioso.
15,8% para el sistema cardiovascular.
9,7% son antiinfecciosos.
9,3% para el sistema respiratorio.
7% para el sistema osteomuscular.
ANEXO 3
nota Puja en Sudáfrica por drogas contra el sida
sección Ciencia/Salud
fecha de publicación 06.03.2001
Puja en Sudáfrica por drogas contra el sida
Se inició ayer una batalla legal entre el gobierno y la industria farmacéutica
PRETORIA, Sudáfrica.- Mientras miles de manifestantes marchaban ayer por esta ciudad para protestar por el alto costo de los medicamentos contra el sida, representantes de 39 compañías farmacéuticas solicitaban al Tribunal Superior la derogación de una ley de medicamentos que los activistas consideran la mejor oportunidad del gobierno de conseguir medicamentos baratos.En el Africa subsahariana, una de las regiones más pobres del mundo, viven más de 25 de los 36 millones de personas infectadas con el virus del HIV. La ley de medicamentos, sancionada en 1997, dio al Ministerio de Salud un poder irrestricto para actuar contra los intereses de las productoras de medicamentos. Permite que el ministerio, "en ciertas circunstancias y con el fin de proteger la salud pública", establezca las condiciones para el abastecimiento de medicamentos a bajo costo.
Las organizaciones humanitarias sostienen que el resultado de este caso determinará si se permitirá a las naciones subdesarrolladas el acceso a versiones genéricas y baratas de medicamentos o si las poblaciones contagiadas con el HIV en esos países quedarán sin tratamiento.
Posiciones enfrentadas
Stephanus Cilliers, abogado de la industria, sostuvo ante el tribunal que la norma es arbitraria y podría utilizarse para importar medicamentos con patente de otros países, donde se venden más baratos, afectando a los tenedores locales de las patentes y al sistema internacional de fijación de precios de la industria.
Mark Hayward, que representa a los activistas contra el sida, dijo que la industria farmacéutica "está haciendo muchas suposiciones antes de ver los reglamentos que acompañarán a la ley".
Por su parte, Glenys Kinnock, miembro del Parlamento Europeo, dijo que Sudáfrica "sufre un apartheid de medicamentos".
ANEXO 4
Clarín Digital
Domingo 09 de mayo de 1999
Buenos Aires, ArgentinaEN LA DISPUTA DE LOS MEDICAMENTOS SE JUEGAN MAS DE 3.500 MILLONES DE DÓ
OLARES
Recrudece la guerra por las patentes
Los laboratorios locales pelean por extender el período de transición, durante el cual evitan pagar regalías a los dueños de las patentes.
SEBASTIÁAN CAMPANARIO
Lo de guerra, en este caso, no es una metáfora. En el conflicto que enfrenta a la mayoría de los laboratorios argentinos con los extranjeros por el tema de las patentes medicinales no hay actores desinteresados: todos pelean por un botín que supera los 3.500 millones de dólares.
Los diputados terminaron de preparar esta semana dos proyectos para modificar la Ley de Patentes sancionada en 1995. Ambos representan, con matices, escenarios pesadillescos para los fabricantes de remedios del exterior y amenazan con desencadenar una tormenta comercial con los Estados Unidos y la Unión Europea. El primero contempla la extensión del período de transición, el lapso fijado en el 95 durante el cual los laboratorios del exterior no cobran regalías por sus productos copiados en la Argentina. De esta forma, la protección a los laboratorios locales no caería en noviembre del año que viene -como estipula la actual ley-, sino recién en el 2005. El segundo proyecto obliga a los fabricantes del exterior que quieran vender sus remedios en la Argentina a producirlos localmente, cláusula similar a la aplicada en la legislación brasileña.
"Calculamos que en diez días la iniciativa que se decida llevar adelante va a tener despacho de comisión y después va a ser aprobada, porque en este tema estamos de acuerdo todos los bloques", dice Humberto Roggero, jefe de la bancada del PJ en Diputados. En un mercado que mueve 4.000 millones de dólares al año (a precio de salida de la fábrica, sin contar la ganancia de las farmacias), los laboratorios extranjeros estiman que el no reconocimiento de su propiedad intelectual les significa pérdidas por al menos 700 millones de dólares. "El monto implicado depende mucho del ritmo de innovaciones y de elasticidades del mercado interno, pero en forma gruesa podemos estar hablando efectivamente de 3.500 millones en cinco años", explica Carmen Suárez, directora ejecutiva de Cooperala, una de las cámaras locales de productores de remedios.
Diez días atrás, CAEME, la cámara que agrupa a 49 laboratorios, en su gran mayoría europeos y estadounidenses, difundió un comunicado durísimo, en el cual se lamentaba "la situación creada a partir de que el Gobierno argentino no cumple con las disposiciones que firmó dentro del acuerdo TRIPS (Tratado de Propiedad Intelectual) del Tratado de Libre Comercio (GATT)". Fue la primera vez que CAEME -que tradicionalmente opera en forma conjunta con las cámaras de laboratorios nacionales en negocios comunes como los contratos con el PAMI-, decide romper lanzas. Hasta ahora, las críticas venían a través de las embajadas. Inmediatamente, Pablo Challú, el director ejecutivo de la más poderosa de las agrupaciones de laboratorios nacionales, CILFA, reunió a sus equipos técnicos y les dio un discurso marcial: "Esto es la guerra".
Por lo pronto, los laboratorios nacionales se sienten seguros con su postura. "La Argentina está en su pleno derecho de reclamar la extensión a diez años en el período de transición", afirma Challú. Saben que cuentan con un eco abrumadoramente favorable en el Congreso y se mueven con comodidad con argumentos bien estudiados: "En países desarrollados como España o Italia el período de transición en materia de medicamentos duró diez años. Cuando este lapso se termine va a haber un proceso de concentración, que implicará menos transparencia en el mercado", agrega Clara Suárez.
"Todavía no sabemos si todo se trata de un circo, si van a salir los dos proyectos juntos o uno solo, pero de todas formas confiamos en que luego el Ejecutivo los vete", especula una alta fuente de CAEME.
Los laboratorios extranjeros saben que ahora no se encuentran en la posición más cómoda. "Cualquier reacción que tengamos va a ser usada como argumento por los diputados para sacar alguna de estas dos leyes, o las dos. Es una situación muy difícil", reconoce la fuente.
Planteo a la OMC
En 1997 el enojo por la Ley de Patentes llevó a los Estados Unidos a castigar a la Argentina retirando el 50% de las posiciones locales de una lista estadounidense de preferencias . La estrategia actual de las multinacionales pasa por planteos directos ante la Organización Mundial de Comercio (OMC).
Semanas atrás denunciaron a la Argentina por no respetar los Derechos Exclusivos de Comercialización (DEC), en el caso de un antidepresivo fabricado por un laboratorio estadounidense. Los DEC son una forma de protección intelectual para ciertos productos, que rige, según lo acordado internacionalmente, aun en los períodos de transición. "La OMC lo está analizando y en unos 60 días se va a expedir. Los Estados Unidos ya ganaron los dos casos similares que presentaron hasta ahora, contra la India y Pakistán", confía Jorge Otamendi, abogado especializado en patentes y actual asesor de CAEME.
Otamendi asegura que "toda la política de patentes argentina está pasando por una situación muy delicada, especialmente, a partir de la intervención del Instituto Nacional de Propiedad Intelectual (INPI)". El INPI es un organismo que se creó durante la gestión de Domingo Cavallo en el Ministerio de Economía, gracias a un crédito otorgado por la Organización de Estados Americanos (OEA). El 1 de febrero, con el argumento de una "reestructuración administrativa", Norma Felix, una funcionaria con buena relación con la Unión Europea y los Estados Unidos que estuvo al frente del INPI desde su creación, fue apartada de su cargo. "La intervención se decretó de la noche a la mañana. Desde ese entonces están todos los trámites parados", dispara la ex funcionaria.
En el medio, la batalla aún presenta varias incógnitas. La principal, en el corto plazo, es a favor de quién terminará jugando el Ejecutivo. Ambas partes juran y rejuran que Economía está a favor de ellos. "Roque, al contrario que Cavallo, ya se manifestó en varias ocasiones a favor de la industria nacional", dice Challú. "Las protestas de los gobiernos extranjeros se están haciendo insostenibles, vamos obligadamente a una salida negociada", afirman en CAEME.
ANEXO 5
nota Medicamentos genéricos en Brasil
sección Opinión
fecha de publicación 30.11.2000
autor (Traducción de Zoraida J. Valcárcel)
Medicamentos genéricos en Brasil
Por Jennifer L. Rich The New York Times
SAN PABLO Habrá ahorrado apenas un dólar, pero su descubrimiento podría llegar a valer mucho más. María de Jesús Viana visitó hace poco a su médico porque "le faltaba el aire". El facultativo le recetó sulfato de salbutamol (un antiasmático). Lo que sucedió después fue una experiencia totalmente desconocida para María, como ya lo había sido para millones de brasileños. "El doctor me preguntó si quería sustituir el medicamento de marca comercial por el genérico -recuerda-. Me pareció una idea estupenda. Es el mismo fármaco, pero más barato." Un frasco de Aerolin, fabricado por Glaxo Wellcome, cuesta 2,45 dólares; el del genérico le costó 1,45 dólar en el local de la cadena Droga Raia de su barrio.Los medicamentos genéricos asoman, por fin, en las estanterías de las farmacias brasileñas, tras largos años de predominio de los productos de marca. Pronto llegarán más, gracias a un emprendimiento conjunto de la compañía israelí Teva, el mayor fabricante mundial de genéricos, y los Laboratorios Biosintética de Brasil. "Esperamos ser el principal fabricante de genéricos del país", dice Omilton Visconde (h.), vicepresidente ejecutivo de Biosintética. Su empresa ya ha lanzado al mercado tres productos. La nueva compañía, BioTeva, introduciría 9 en lo que resta del año y un total de 50 para fines de 2001.
En la actualidad, hay unos 70 disponibles en el mercado local. A juicio de los expertos, es una cifra prometedora habida cuenta de que los primeros genéricos fueron introducidos a comienzos de este año, una vez que el Congreso aprobó la nueva legislación. Las compañías se apresuran a solicitar la aprobación reglamentaria para aprovechar un mercado abierto de par en par. Según el último recuento, ya se han aprobado unos 190 genéricos; su número aumenta casi a diario. A la larga, podrían circular en el mercado varios miles, por cuanto la ley de patentes brasileña, sancionada hace apenas cuatro años, establece la fabricación libre de todos los fármacos desarrollados antes de su entrada en vigor.
Tendencia irreversible
El Ministerio de Salud espera que a fin de año las ventas ronden los 150 millones de dólares. Los grupos industriales dicen que el mercado podría alcanzar los 2000 millones de dólares en los próximos cinco años, captando un 30 por ciento del mercado general. Brasil ya es el sexto consumidor mundial de medicamentos, detrás de los Estados Unidos, Japón, Alemania y Francia, pese a que aproximadamente la mitad de su población carece de recursos para comprar fármacos con marca registrada. "La tendencia es irreversible. Nuestra política es promover los genéricos", expresa Eugenio de Zagottis, director comercial de Droga Raia, la tercer cadena de farmacias del país, donde los genéricos ya representan alrededor del 3 por ciento de sus ventas totales.
No obstante, el mercado está en pañales y aún queda mucho por hacer para educar a los médicos, los farmacéuticos y el público acerca de las ventajas de los genéricos. "Hoy por hoy, el gran secreto es cómo convencer al consumidor. El es quien reparará en los productos más baratos y consultará a su médico acerca de los genéricos", explica Carlos Sánchez, presidente de EMS-Sigma Pharma. Su empresa fabrica o importa unos 50 genéricos en sociedad con el fabricante canadiense Aphotex.
Según un estudio de Biosintética, el 70 por ciento de los genéricos se venden porque los consumidores se los piden a sus farmacéuticos en sustitución de los medicamentos de marca. Los expertos prevén que el consumidor seguirá siendo su promotor hasta tanto las aseguradoras de salud empiecen a incluir en su cobertura los medicamentos de venta bajo receta (actualmente, muy pocas lo hacen).
La potencia inicial del mercado supera las expectativas. Esto se debe, en gran parte, a la indignación popular que suscitó, en julio, el resultado de una investigación parlamentaria: varios laboratorios, locales y multinacionales, fijaban precios abusivos aprovechando la falta de competitividad y de control federal del mercado. Desde entonces, el gobierno ha emprendido una promoción agresiva de la producción y uso de genéricos. "Estamos revisando las normas vigentes para los genéricos. Queremos agilizar el procedimiento cuanto sea posible, sin alterar los requisitos técnicos que garantizan la eficacia y seguridad de los medicamentos", dice Mauricio Vianna, funcionario de la Agencia Nacional de Vigilancia Sanitaria a cargo de los fármacos de venta bajo receta. (La Anvisa es el ente regulador.) En la actualidad, el examen de los estudios de bioequivalencia y la aprobación del genérico requieren seis meses de trámites.
Quienes critican esta política aducen que el gobierno aún tiene un largo camino por recorrer para asegurar un mercado próspero. "No basta que elabore una política de promoción nacional de los genéricos. Debe demostrar que posee los medios necesarios para garantizar permanentemente la calidad de los productos", advierte Ciro Mortella, presidente ejecutivo de la Asociación Brasileña de la Industria Farmacéutica.
ANEXO 6
NOTA: la mención de este laboratorio en particular es circunstancial y solo a modo de ejemplo. La mayoría de los casos tomados de MaLAM se refieren a laboratorios internacionales. Debido a este tipo de iniciativas, los laboratorios han ido mejorando sus normas internas. Sin embargo, en muchos casos los laboratorios locales tienen menos presión por mantener una publicidad ética. Les agradeceré me informen de casos locales para tomar como ejemplo.
Traducido y adaptado del boletín de MaLAM
Publicidad médica
Smith Kline Beecham promociona Augmentin (amoxicilina y clavulanato de potasio) en Centroamérica con el eslogan "los productos genéricos no cumplen los estándares de calidad de SKB".
En el boletín mensual de MaLAM (Lobby Médico para el
MárketingMarketing Adecuado) el tema del mes es una publicidad anti genéricos, distribuida por Smith Kline Beecham (SKB) durante 1998 en Costa Rica y Nicaragua. La creencia de que las drogas más caras son mejores que las más baratas es entendible y difundida. Sin embargo, frecuentemente no está justificado. Cuando no está comprobado, que las drogas caras son mejores que las más baratas, existe el riesgo de malgastar los recursos de salud.A menos que SKB pueda justificar su aviso anti
genéricos, parecería un serio ataque al trabajo realizado por muchas organizaciones, como el departamento de drogas esenciales de la OMS, para permitir a las personas de menores ingresos alrededor del mundo el acceso a drogas esenciales.
Se envió esta carta a SKB:
Señor presidente de SKB, UK:
En vuestro reporte anual de 1998 declaran que "nuestra fortaleza se apoya en lo que valoramos: los clientes, la innovación, la integridad, la gente y nuestro desempeño. En SKB somos personas con determinación, trabajando juntos para hacer la vida de la gente más saludable, esforzándonos en todo por ser "simplemente" la mejor compañía del cuidado de la salud, a juicio de todos a los que servimos: clientes, proveedores, empleados y la comunidad global."
Durante 1998, distribuyeron un
aaviso que contenía una foto de un polvo blanco con la leyenda "amoxicilina y clavulanato de potasio desarrollado y manufacturado por SKB" y una foto de un polvo amarillo con la leyenda "amoxicilina y clavulanato de potasio usado en los productos genéricos". (ver aviso)La publicidad menciona que el cambio de color es indicativo de impureza o degradación de los estándares de calidad.
En el aviso, no menciona citas bibliográficas ni justifica estas afirmaciones.
Esta carta pretende darles la oportunidad de expresar vuestro punto de vista, para poder valorar los objetivos de brindar tratamiento apropiado.
Esperamos que ustedes puedan proveer respaldo o, en caso contrario, cambiar la promoción de Augmentin. Esperamos que el diálogo nos permita mejorar la promoción de drogas para beneficio del público, de los profesionales de la salud y de vuestra compañía.
Ustedes comparan Augmentin y genéricos, en base a diferencias de color entre los productos. Afirman que el color del genérico significa que contiene impurezas o se encuentra degradado. Esto implicaría que el producto genérico podría ser inferior al de SKB. Sin embargo, el aviso no provee información sobre este punto. La falta de información clínica en cuanto al color, velocidad de acción, superioridad farmacocinética, potencia y sus consecuencias como la sensibilidad microbiológica, no es aceptable, y
la superioridad de una sobre otra, sólo puede ser establecida por estudios clínicos comparativos controlados.
Preguntas:
· ¿Tiene SKB alguna evidencia para demostrar que el producto genérico es inferior clínicamente?.
· Si fuese así, ¿SKB publicó esa evidencia?.
· Si no lo hizo ¿por qué no?.
· ¿Considera SKB que la superioridad de un producto sobre otro puede ser afirmada sin estudios de comparación clínica?.
· ¿Puede justificar la afirmación hecha por su compañía que los productos genéricos no cumplen los estándares de calidad de SKB?.
· De ser así ¿puede justificar esta afirmación extrema?
· Si no, ¿Qué medidas tomarán para evitar que estos errores
noocurran nuevamente?
Atentamente
MaLAM
Adjuntan en el boletín una nota para ser enviada por los lectores a SKB con la Leyenda: "He leído la edición de MaLAM sobre la promoción de Augmentin por su compañía en Centroamérica, y agradecería recibir una copia personal de su respuesta"
Dr. ................... Farmacéutico .................... Enfermera.........................
Traducción libre por Hortensia Vilasetrú
Volumen 1, Número 1--- Verano 1996
REVISTA INTERNACIONAL DE PSICOPATOLOGÍA, PSICOFARMACOLOGÍA Y PSICOTERAPIA
ISSN: 1088-6710
Los Tejemanejes de la Industria Farmacéutica.
Dr. Seymour Fisher
Centro de Control de Medicamentos.
Departamento de Psiquiatría y Ciencias de la Conducta.
Universidad de Texas. Rama de la Medicina.
Galveston TX 77555-0441
RESUMEN
En este informe se reimprimen tres ensayos que fueron originalmente distribuidos por Internet, al Foro de Psicofarmacología de InterPsych, a fines de 1995. La Parte I refiere un hecho real en el que, mostrando su falta de ética, una compañía farmacéutica obstaculizó la publicación de un artículo científico que informaba resultados clínicos desfavorables a los intereses de esa compañía. Se continuó en la Parte II, con documentación adicional en la que se mostraba la influencia ejercida por las empresas farmacéuticas en la investigación académica y, además, se planteó el tema de la influencia dominante de la industria en el entrenamiento de médicos jóvenes. La Parte III revelaba algunas de mis ideas con respecto a la esperanza de poder despertar el interés público para ejercer presión moral en la industria farmacéutica.
Cite como: Fisher S Hanky-Panky in the Pharmaceutical Industry. Int J Psychopath Psychopharmacol Psychother 1996, 1 (1). URL http://www.psycom.net/ijppp.v1n1.html
PARTE I (Primero publicado en Internet a fines de julio de 1995)
¿Quiere la industria farmacéutica que los médicos y los pacientes aprendan más sobre los posibles efectos colaterales de las drogas recientemente comercializadas? Pienso que ha llegado el momento de hacer público un único y atroz ejemplo de cómo las compañías farmacéuticas individuales pueden influir en la publicación de los resultados de la investigación clínica que perjudican sus intereses financieros. (También he documentado casos en los que la industria farmacéutica puede influir insidiosamente en la publicación de otros manuscritos y aún en el apoyo de proyectos de investigación NIH que tratan sobre reacciones adversas de drogas recientemente comercializadas. Pero ésa es otra historia, quizás, para otro momento).
Para aquellos que no me conocen, me gustaría señalar, en primer lugar, que no tengo ningún interés personal al hacer público este tema. Estoy por cumplir los 70 años de edad y ni mi carrera profesional ni mi trayectoria académica necesitan de ningún adorno (se puede encontrar un breve curriculum vitae en "Quién es Quién en América").
Luego, yo los insto a que lean el artículo "la Vigilancia de Postmarketing por Pacientes Autosupervisados: los Datos Preliminares para Sertralina contra Fluoxetina", en la publicación de julio de 1995 del Journal of Clinical Psychiatry (1995;56:288-296). Este trabajo está basado en gran cantidad de datos que indican que muchas de las reacciones adversas que, según se sabía, eran producidas por la Fluoxetina (Prozac), fueron advertidas, aún con mayor frecuencia, por pacientes tratados con Sertralina (Zoloft). Las tablas también incluyen sugerencias al médico con respecto a la edad y sexo de mayor riesgo en los pacientes. Zoloft es fabricado por Pfizer Incorporated (División Roerig). El manuscrito se aceptó para su publicación el 12 de mayo de 1994.
El 8 de diciembre de 1994 el Director me escribió para comunicarme su temor de que “nuestros lectores, en su mayoría clínicos, pudieran interpretar los resultados más literalmente que nuestros colegas investigadores. Esta aprehensión me llevó a bosquejar el comentario adjunto, que me gustaría publicar junto con su artículo.” Aunque ninguno de los tres críticos del periódico que habían recomendado la publicación originalmente expresó esta aprehensión, el comentario propuesto por el Director fue titulado “Qué me producirá esta droga, doctor?”, y tácitamente implicaba que nuestros resultados y conclusiones podrían ser espurios.
Yo contesté a esa carta el 20 de diciembre, indicando que la mayoría de las críticas sustantivas que él planteaba en el comentario propuesto, eran simplemente inválidas, y que en cambio sugería que los resultados de la investigación, junto con el debate de los resultados cuidadosamente calificados del artículo, deberían poder hablar por sí mismos.
Carta del Director fechada el 30 de diciembre: “He corregido y (espero que usted estará de acuerdo) ‘suavizado’ algunos de mis comentarios. Espero que ahora el escrito le resulte más cómodo”. Su comentario corregido incluía frases como “Sería simplista y prematuro, sin embargo, tomar este informe como si fuera palabra santa y llegar a la conclusión de que en realidad el Sertralina produce reacciones adversas con mayor frecuencia que la Fluoxetina.” Y el párrafo final decía: “El informe de Fisher y otros hace reflexionar y puede elaborar hipótesis para pruebas futuras. La incidencia real de los efectos colaterales de estos dos SSRIs se aclarará con el tiempo y con más estudios.” (Se incluyeron advertencias similares en la sección de discusión del artículo, pero sin el tono peyorativo del Editorial propuesto.)
En febrero de 1995, cuando aún no habíamos recibido la prueba de la página nueve meses después de la aceptación del artículo, telefoneé a la oficina editorial para pedir información. Me dijeron que se había programado para la edición de mayo. Sin embargo, en abril, cuando todavía no habíamos recibido ni página ni prueba de galera, y cuando una nueva llamada telefónica reveló que la fecha de publicación había sido ahora pospuesta hasta julio, emprendí un rápido “plan de investigación.” Esto llevó a una carta que escribí el 1° de mayo al Director, en la que expresé mi opinión de que la publicación de su Comentario propuesto sería extremadamente injusta a menos que yo también tuviera la oportunidad de responder al Editorial. Lo que sigue era la refutación por mí propuesta:
COMENTARIO SOBRE: “¿Qué me producirá esta droga, doctor?”
En esta edición, un artículo de Fisher (Fisher S, Kent TA, y Bryant SG, 1995) presenta los datos de más de 2,700 pacientes con Fluoxetina y Sertralina que usan un método de vigilancia de postmarketing bien-validado, desarrollado para señalar las posibles reacciones adversas a la droga (ADR). Los resultados preliminares indicaron que muchas de las reacciones adversas que, según se sabía, eran producidas por la Fluoxetina, eran advertidas, aún con mayor frecuencia, por pacientes tratados con Sertralina. El artículo se acompaña de un Comentario Editorial (Gelenberg AJ, 1995), instando a los lectores a “que no lleguen a la conclusión de que el Sertralina produce, en realidad, mayor frecuencia de reacciones indeseadas que la Fluoxetina.” Ciertamente, ésta podría resultar una conclusión prematura. Pero se puede plantear una pregunta legítima acerca de por qué se está singularizando este trabajo particular, cuando las "conclusiones" implícitas en más de 90% de los trabajos publicados en esta Revista y en otras revistas psiquiátricas, también están generalmente sujetos a interpretaciones alternativas, no todos los cuales pueden ser igualmente verosímiles.
El Director hace notar que se puede haber dado un enfoque parcial porque nosotros nos basamos “en un porcentaje de voluntarios comparativamente pequeño [cerca del 20%] de la población abordada". Pero todos los estudios de vigilancia postmarketing usan sólo una pequeña muestra de la población de interés total (Baum C y Anello C, 1989). La pregunta más saliente es si hay una razón basada en la evidencia empírica para creer que las muestras seleccionadas finalmente favorecen más a un grupo de drogas que al otro. Si con nuestro método la selección resultara tendenciosa, no nos hubiera sido posible detectar, en nuestros estudios de validación, tantos ADRs comúnmente aceptados para varias drogas (Fisher S, 1995; Fisher S, Bryant SG y Kent TA, 1993). Sin embargo, siempre es posible en cualquier método de vigilancia postmarketing que los sujetos voluntarios (incluso médicos que son instados a informar posible ADRs al FDA) o aún las muestras del registro médico podrían introducir un parcialidad. De manera parecida, aunque el Director cuestiona “si esta técnica está bien preparada para comparar incidencias de eventos adversos entre un agente más nuevo y uno más viejo," también reconoce que los resultados de nuestros estudios anteriores junto con los controles estadísticos usados en los análisis de los datos sugieren que lo que estamos viendo en este estudio del Sertralina no es simplemente un fenómeno “de droga más nueva”.
Entonces, de nuevo: ¿por qué ese editorial alarmante? Un examen de 119 artículos publicados en esta Revista desde julio de 1993 hasta abril de 1995 (sin incluir suplementos, monografías, ni la emisión de octubre de 1994, que no pudo conseguirse) ofrece algunas pistas. La extensión media de los artículos era de algo menos de seis páginas (algo más en unos pocos trabajos); la demora media para su publicación, definida como la cantidad de meses entre la fecha de aceptación y la fecha publicación fue de ocho meses—por lo cual la mayoría de los autores agradecen al Director. Sólo dos de los 119 artículos no fueron publicados hasta 11 meses después de la aceptación, y ninguno llegó a tener un retraso de más de un año. No había ninguna relación entre la extensión de un artículo y la demora en su publicación.
Aunque algunos números de la Revista incluyeron un "comentario" sobre algún trabajo específico, ninguno de ellos fue firmado por el Director. De hecho, con una mirada retrospectiva hasta las ediciones publicadas en 1990 se encontró un sólo Editorial anterior que también enfocó el tema de las reacciones adversas a las drogas (Gelenberg AJ, 1992). Aún así, nuestro trabajo sobre el Sertralina no sólo indujo a escribir un Editorial, sino que tardaron más de un año en publicarlo, desde el 12 de mayo de 1994, fecha en que se aceptó formalmente.
Durante los últimos 4 de los 10 años que nos llevó el desarrollo de nuestro método de postmarketing [apoyados continuamente por el Instituto Nacional de Salud Mental junto con otras fuentes de recursos no farmacéuticas], hemos tenido plena conciencia del hecho de que es obvio que una vez que una nueva droga ha sido comercializada, muchas compañías farmacéuticas no quieren someterlas a una supervisión cuidadosa para detectar posibles ADRs –en particular los métodos que sistemática y sensiblemente comparan posibles perfiles de ADR. El Director de esta Revista merece elogios por su valor para publicar nuestro trabajo sobre Sertralina/Fluoxetina, pero uno no puede dejar de preguntarse hasta qué grado pueden haber contribuido las presiones externas tanto para la demora en la publicación como para la necesidad por un Editorial admonitorio.
Actualmente, la preferencia clínica primordial de un agente psicofarmacológico en lugar de otro no está tan determinada por las verdaderas diferencias en la eficacia terapéutica (la mayoría de los antidepresivos en la mayoría de las situaciones son casi igualmente eficaces), sino por las diferencias presuntas en sus perfiles de ADR (Gelenberg AJ y Schoonover SC, 1991).
Las investigaciones sistemáticas sobre servicios sanitarios llevadas a cabo en la realidad de la farmacoterapia postmarketing es de suma importancia para que los clínicos sean competentes en la práctica del cuidado del paciente en forma racional, basada empíricamente. En resumidas cuentas, aunque la publicación de nuestro trabajo pudiera tener un efecto adverso en las ventas de la compañía, el Sertralina parece tener un perfil ADR más problemático que la Fluoxetina, particularmente en lo que respecta los ADR conocidos que parecen ser comunes a la clase SSRI. Pero sólo la investigación sistemática y la observación clínica continua y perspicaz juzgarán si estos resultados preliminares basados en la supervisión del mismo paciente realmente dan respuestas más acertadas a la pregunta del paciente, “¿Qué me producirá esta droga, doctor?”.
[Fin de la refutación]
Un par de semanas después de haber enviado yo la Respuesta al Editorial propuesta que antecede, recibí una llamada telefónica del Director, que en ese momento se encontraba en Miami, en una reunión de la American Psychiatric Association, y dijo que no le era posible publicar mi comentario en la forma propuesta. Él estaba de acuerdo en que yo tenía derecho a un espacio para la refutación, pero me informaba que yo tendría que modificar su contenido. Le dije que lo consideraría. Unos días más tarde, volvió a telefonear para decirme que había decidido suprimir su editorial propuesto, y que por consiguiente yo podía olvidarme de la refutación. En nuestra conversación admitió que había tomado esta decisión después de hablar con representantes de Pfizer en la reunión de la APA.
De modo que usted no encontrará en la edición del Journal of Clinical Psychiatry de julio de 1995 el Comentario Editorial con su respuesta junto con el artículo de Fisher y otros, que finalmente pudo llegar a los médicos (y a sus pacientes) 14 meses enteros después de la aceptación.
De esta sucesión de hechos surgen algunas preguntas obvias:
1. ¿Por qué el Director esperó no menos de siete meses después de la aceptación del trabajo para decidir que debía escribir un editorial para acompañar la publicación del artículo? ¿Tardó varios meses en llegar a Pfizer, que subvenciona fuertemente el Journal, la noticia de que el trabajo estaba en la prensa?
2. ¿Por qué finalmente la publicación del artículo tardó 14 meses, cuándo la mayoría de ellos se publicaba dentro de los ocho meses y ningún otro artículo en ese Journal, entre 1993 y 1994, había tenido un retraso de más de 11 meses? ¿Quería Pfizer aplazar lo más posible la publicación mientras las ventas de su Zoloft se fortalecían? (Una coincidencia curiosa: notamos que el artículo líder en ese número de julio del Journal, no sólo está firmado por el Director, sino que alega haber sido aceptado en abril de 1994).
3. ¿Y por qué el Director decidió a último momento, después de consultar con representantes de Pfizer, que no publicaría el Editorial? Después de leer el comentario de la refutación propuesto. Y después de haberlo leído, ¿temía ahora Pfizer que la publicación del editorial con la consabida refutación, además de enfatizar el perfil de efectos colaterales aparentemente desfavorables para Zoloft, podrían realmente servir para que los lectores se dieran mejor cuenta del papel de Pfizer en el proceso de la publicación?
PARTE II (Primeramente publicado en agosto de 1995)
Hace aproximadamente un mes mandé a varias listas de correo y grupos de información de Internet una cronología basada en los hechos que consistía en la publicación de un artículo sobre la vigilancia postmarketing, en la que se mostraba cómo una compañía de medicamentos (Pfizer Incorporated) ostensiblemente había forzado los límites de la ética cuando sus ganancias se vieron amenazadas. El artículo, publicado en la edición de julio del Journal of Clinical Psychiatry (1995;56:288-296), se basaba en una importante cantidad de datos que indicaban que muchas de las reacciones adversas que eran notoriamente causadas por la Fluoxetina (Prozac), estaban siendo registradas con frecuencia aún mayor por los pacientes que eran tratados con Sertralina (Zoloft). Zoloft es fabricado Pfizer. Hasta ahora he recibido unas 100 contestaciones (muchas más de listas de correo que de grupos de información), todas dando su apoyo.
Algunos lectores interpretaron que la intención de mi publicación original tomaba como objetivo al Director del Journal of Clinical Psychiatry. Yo esperaba haber sido claro en que mi frustración no se debía tanto al Journal como a los anunciantes de la compañías de medicamentos, que pueden hacer muy incómoda la vida del más concienzudo y escrupuloso Director de revistas.
Ahora, como Parte II, me gustaría ofrecer los siguientes hechos relacionados adicionales, con la esperanza de que más de ustedes, ya sean médicos, científicos, “ethicists”, o simples consumidores de medicinas prescriptas que se interesen puedan darse cuenta de las muchas maneras en que la industria farmacéutica, sin los menores principios éticos, intenta influir en la adquisición y difusión de conocimientos sobre sus medicamentos a los profesionales de la medicina y a sus pacientes. Creo que los colegas que me conocen, están de acuerdo en que yo no soy proclive a las reacciones avinagradas ni a ideación paranoica, pero lo que ha surgido gradualmente durante los últimos cuatro años es un panorama muy desagradable de esfuerzos coordenados, completamente faltos de ética, tendientes a influir en las publicaciones psicofarmacológicas, en la educación, e incluso en el apoyo a la investigación.
Durante nuestra investigación sistemática sobre medición de frecuencia de reacciones adversas por drogas recientemente comercializadas, ésta no es la primera vez que mis colegas y yo hemos obtenido evidencia de compañías de medicamentos que ejercen presión sobre críticos y directores de revistas. Y Pfizer no fue la única compañía. Lilly hizo esencialmente lo mismo la primera vez que intentamos publicar nuestro trabajo sobre Fluoxetina contra trazodone, que luego llegó a publicarse más de dos años después de haberlo escrito y presentado por primera vez (Fisher S, Bryant SG, y Kent TA, 1993).
Tampoco el proceso de revisión del subsidio NIH para la investigación es inmune a virus similares. Recientemente, después de 10 años de financiamiento continuo del Instituto Nacional de Salud Mental (NIMH), el apoyo posterior fue terminado abruptamente, cuando por lo menos dos de los miembros de la sección de estudio original --uno era el presidente (!), otro era el revisor principal-- habían estado dirigiendo numerosos estudios sobre medicamentos subvencionados por compañías y contribuyendo sustancialmente, ya fuera directamente o indirectamente al ingreso global de los revisores. Increíblemente, el NIH asegura que no había conflicto de intereses en la revisión porque “La investigación que se centra en algo ajeno a la evaluación de la eficacia de un agente farmacológico particular, no representa una situación de conflicto de intereses financieros” (la redacción es idéntica al original).
Después de haber servido personalmente en las secciones de estudio del NIH, sé que algunos miembros del comité que revisan los subsidios dejan conocer a las compañías de medicamentos (faltando así a la ética) información sobre las solicitudes de subsidio que podrían ser desfavorables a los intereses de la industria (por ejemplo, vigilancia postmarketing de nuevos medicamentos). Ahora, si un miembro del comité recibe también parte de su ingreso total por su tarea de dirigir pruebas médicas y/o consultas importantes para esa compañía, yo sostengo que esa persona está en un conflicto de intereses potencial cuando llega el momento de discutir y votar la solicitud de subsidio. Siempre se filtra información sobre quién votó a favor o en contra de determinada solicitud, y un miembro del comité sabría que un voto de aprobación para un subsidio que a la industria farmacéutica le gustaría ver eliminado, podría llevar a una pérdida de ingresos.
La conclusión, aquí, parece ser que, desde el punto de vista del NIH, un miembro del comité puede estar en conflicto de intereses si como resultado de su voto llega a obtener una GANANCIA en sus ingresos personales. Pero si una fuente externa ejerciera una intimidación sutil, dice el NIH que no hay ningún conflicto de intereses, aún cuando el voto en una dirección podría resultar en la PÉRDIDA de un ingreso personal. ¿Esto, para usted, tiene sentido?
¿Quiere que siga haciéndolo reflexionar? ¿Hay tantos de nuestros hospitales y facultades de medicina tan quebrados que sus residentes tienen que conseguir almuerzos gratuitos acompañados por los argumentos de venta de los representantes de las compañías de medicamentos, sólo comparables con los mejores avisos de la televisión?
Por supuesto, esto asegura que se imparta a los residentes la “"verdadera” información sobre la eficacia y los efectos colaterales de sus productos comparados con otras drogas similares, sin ninguna necesidad de que esos trabajadores médicos que se están entrenando tengan que molestarse en consultar los folletos de información publicados.
Yo también fui alcanzado por la presencia omnipresente pero discreta de los representantes de compañías de medicamentos en Grand Rounds y otras conferencias donde los altos honorarios del disertante vienen de la compañía. ¿Están mirando y escuchando Papá y Mamá, para asegurarse de que en la oficina central sepan si el disertante dice algo malo sobre sus productos?
Una de las respuestas que recibí a mi “post” original sugería que agrupos tales como lal APA (American Psychiatric Association) y NCDEU (NIMH’s annual New Clinical Drug Evaluation Units meeting) deberían ventilar públicamente el problema.
A esto, el Dr. Ivan Goldberg comentó en línea:
>Quizás yo sea más cínico de lo que me gusta creer, pero con el papel importante jugado por "industria" tanto en la APA como en la NCDEU, le apuesto $100 a que no importa lo mucho que presione cualquiera de nosotros, no se programará en la APA ni en MCDEU ningún simposio sobre la influencia de las compañías de medicamentos sobre el financiamiento y la publicación de estudios postmarketing de agentes psicofarmacológicos.
La mayoría de los principales actores de psicofarmacología de la APA y NCDEU también tienen roles de poder en el American College of Neuropsychopharmacology (ACNP). Por haber sido presidente del ACNP, conozco de primera mano algunos hechos que muestran con qué valentía actúa la Facultad (cuyos miembros comprenden a representantes de compañías de droga así como académicos y representantes del gobierno) cuando la industria farmacéutica se muestra descontenta por algo:
Para su reunión número 1993, la ACNP había fijado una reunión con almuerzo precisamente sobre el mismo tema mencionado más arriba en el “post” del Dr. Goldberg. Sin embargo, a último momento el tema se cambió por otro mucho más importante: “Pueden usarse los antidepresivos SSRI para hacer que los perros basset actúen como los ovejeros alemanes?”.
Para su reunión 1994, el Consejo de la ACNP estaba considerando hacer participar a los directores de varias revistas de psiquiatría y psicofarmacología, en una sesión de grupo de estudio abierta a todos los miembros de la Facultad. El tema iba a ser un debate sobre la ética de los revisores de subsidios y revistas al informar a las compañías de medicamentos sobre los subsidios y manuscritos presentados, con contenido desfavorable a los intereses de una compañía. Como corolario, se esperaba que el grupo de estudio también debatiera las presiones de los anunciantes de las compañías de medicamentos sobre los directores de revistas. El grupo de estudio propuesto nunca se realizó.
Aquí estamos hablando de un tema espinoso que nadie quiere tratar oficialmente. ¿No hay alguien más por ahí afuera que quiera involucrarse contactándose con sus colegas, representantes electos y cualquier amigo que puedan tener en los medios de comunicación?
De algún modo deberíamos poder advertir ruidosa y claramente a la “ética” industria farmacéutica que, al mismo tiempo que admiramos y agradecemos sus muchos logros terapéuticos, nosotros no vamos a tolerar que antepongan los dólares a la verdad. ¡Excelsior!!
Si usted ha leído hasta acá, muchos gracias por su interés. Espero que empiece a hacer algo.
PARTE III (Primeramente publicado en septiembre de 1995)
Durante el mes pasado, ha estado fluyendo de Internet un gran surtido de respuestas a la publicación de la Parte II. Algunos piden simplemente copias de la Parte I, algunos dan consejos, otros expresan sus reacciones. Los hilos que penden de los títulos “Tejemanejes” y “Prácticas Faltas de Ética - la Industria de los Medicamentos” en varias listas de correo y newsgroups (por ejemplo, sci.med., sci.med.psychobiology, sci.med.pharmacy, psycho-pharm@netcom.com) constituyen una lectura fascinante. Llegaron algunos “posts” enviados por verdaderos chiflados (algunos doctorados!) con reacciones viscerales ante cualquier insinuación de que pueda haber algún problema con la ética dentro de la “ética” industria farmacéutica. Una respuesta, sin embargo, venía de un individuo evidentemente bien informado y reflexivo. Como su posición estaba tan claramente planteada y probablemente representa la opinión de muchos otros, pienso que merecía una respuesta separada. Lo que sigue es en esencia lo que envié por Internet entre el 10 y el 12 de septiembre: * * * * * A 09:33 PM 9/9/95 -0400, William (Bill) Boyer, M.D. ,escribió:
>El Dr. Fisher plantea asuntos importantes en su bien escrito>”update”. Sin embargo me permito discrepar con lo que veo>como una acusación en su artículo: que hay, en algún lugar, de algún modo, cierta solución muy ética, y sin embargo práctica, para la influencia de las compañías farmacéuticas.>Como insinúa el Dr. Fisher, la investigación cuesta dinero, y como él señala, hay dos fuentes de dinero, las compañías farmacéuticas y los recursos cada vez más limitados del gobierno. Sin financiación, poca será la investigación con cierto mérito que podrá hacerse. Punto.>La mejor, aunque no la perfecta, solución, reside en el sistema de libre empresa y competencia. Así es cómo se evita la influencia indeseada en otras áreas de la economía. Mientras haya varias compañías farmacéuticas que compitan entre ellas para obtener beneficios y evitar pérdidas; mientras haya varias publicaciones científicas que compitan entre ellas por prestigio y por publicidad, habrá límites intrínsecos al grado de influencia que cualquiera de ellos pueda ejercer. Esto va a suceder, no sólo porque su poder se verá diluido, sino porque las acciones indebidas de cualquiera de ellos podría abrir una oportunidad para sus competidores. Yo también creo firmemente que cualquiera que se gradúa como profesional es (o era) lo suficientemente listo para evaluar de manera apropiada el material que se le presenta junto con el "almuerzo gratuito".>>Veo el llamado del Dr.Fisher a "hacer algo", incluyendo contactarnos con nuestros legisladores, como un llamado de facto para aumentar el control gubernamental que, como muestra la historia, es la manera más segura de reprimir la ciencia.>>Nuevamente, el statu quo no es necesariamente bueno,>pero todas las alternativas parecen peores.>>William (Bill) Boyer, M.D.>----------------------------------------------------------> Si usted prefiere Cogito ergo sum to Non sum qualis eram> Usted está poniendo a Descartes ante Horacio - J. Thurber>----------------------------------------------------------Desearía sinceramente que fuera verdad que, como lo ve el Dr. Boyer, la competencia entre las compañías farmacéuticas fuera suficiente para resolver algunos de los serios problemas éticos que ha estado enfrentando la industria durante muchos años. Porque él dice que no ve ninguna "solución práctica para la influencia de las compañías farmacéuticas", él está satisfecho con el statu quo. Bien, el estado presente no es exactamente como el pasado (Nota de la Traductora: El Dr. Fisher está haciendo un juego de palabras con “statu quo” que significa “en el mismo estado que (antes))”; por consiguiente, yo creo (a) hace falta que haya algún tipo de acción, y (b) HAY alternativas viables.
Yo también estoy muy a favor de la competencia --que en la mayoría de las áreas puede producir beneficios económicos, tecnológicos, y materiales para el consumidor. Sin embargo, la historia nos muestra que la competencia sin restricción siempre lleva al desastre para el consumidor. ¿No creo que nadie argumentaría que la FDA debería abolirse y que debe dejarse a las compañías individuales decidir qué drogas hay que comercializar: ¿suponemos que la competencia entre las compañías de medicamentos aseguraría la comercialización sólo a las drogas seguras? ¿Y dónde estaban los efectos beneficiosos de la competencia sobre el consumidor en los días anteriores a las enmiendas de Kefauver-Harris, cuando no había que demostrar que un medicamento era eficaz para poder venderlo en el mercado? Es sencillamente falso que la conducta ética va a prevalecer “porque las acciones indebidas de una compañía puede abrir una oportunidad a sus competidoras." Si se permite que las compañías de medicamentos (u otras compañías) compitan entre ellas sin restricciones, es algo así como nombrar a Mark Fuhrman jefe del departamento de Asuntos Internos de Los Angeles. Para ahorrar el espacio, no voy a extenderme ahora en este punto, especialmente desde que no afecta directamente a la pregunta “¿Qué tendríamos que estar haciendo ahora?"
Así que vayamos al grano. Como hice notar anteriormente, hay, sí, alternativas al statu quo, pero el Dr. Boyer ha interpretado mal mis ilusiones. Contrariamente a su temor de que mi “llamado a hacer algo” aumentaría el control gubernamental, el aumento de los controles gubernamentales NO son ciertamente lo que yo estoy defendiendo o esperando lograr (¡Dios nos libre!). El nivel óptimo de las regulaciones federales en los negocios, debe ser exactamente igual que para la buena farmacoterapia: la dosis mínima necesario para lograr el efecto deseado (es decir, máximo beneficio para el paciente / consumidor).
Yo creo que el Dr. Boyer subestima en gran forma el poder que tienen las “personas” para efectuar el cambio conductual –aún en el muy competitivo mundo de los negocios. Yo podría hacer una larga lista de hechos en los que la presión de la gente (incluyendo posiblemente notables amenazas de legisladores que, después de todo, hablan en favor de las personas) ha llevado a cambios en las políticas corporativas. Para mencionar sólo una, mire cómo las compañías de medicinas han reducido sus "seminarios" exóticamente localizados después del segmento de "60 Minutos" en las vacaciones pagas para los médicos y sus esposas. (Y por favor, no hagamos acá debates semánticos con el uso del término “vacaciones”. Si usted piensa que el principal propósito subyacente de aquellos "seminarios" era la genuina continuación de la educación médica, entonces yo supongo que usted es igualmente susceptible a los argumentos de toda la industria tabacalera.)
Sí, Dr. Boyer, yo creo que si suficientes personas alzan sus voces, la publicidad resultante puede traer suficiente presión a la industria farmacéutica como para tomar un camino moralmente más alto --y nosotros VEREMOS algunos cambios.
A propósito, ¿por qué todos tenemos la tendencia a creer que NOSOTROS, los afortunadamente mejor educados, los pensadores lógicos, obviamente no podemos ser comprados tan fácilmente? Esto no se mantiene muy en pie si lo examinamos bajo la lupa, cuando un "almuerzo gratis" tras otro, sea grande o pequeño, se amontona con el tiempo y se desarrollan las amistades. Además, no debemos engañarnos con el argumento de que como estamos expuestos a los representantes de TODAS las diferentes compañías, no vamos a favorecer únicamente a una o a dos --¿no hay una imperiosa necesidad en Washington de reformar el “lobbying” a pesar del hecho de que nuestros representantes elegidos se encuentran continuamente con tantos, variados y competitivos grupos de interés especiales?
Sospecho que la única diferencia real entre nuestras opiniones, se refieren al optimismo en oposición al pesimismo frente a la naturaleza corporativa. Yo creo que si un número suficiente de nosotros habla de manera contundente, la industria farmacéutica elevará sus normas éticas. Dr. Boyer, ¿por qué no se une a mí para ver si se justifica un poquito más de optimismo? No hay nada que perder.
REFERENCIAS
1. Baum C, Anello C. (1989) The spontaneous reporting system in the United States. In Strom BL (Ed) Pharmacoepidemiology. New York: Churchill Livingstone. Pp. 107-118.
2. Fisher S. (1995) Patient self-monitoring: A challenging approach to pharmacoepidemiology. Pharmacoepidemiology and Drug Safety. 4; 359-378.
3. Fisher S, Bryant SG, Kent TA. (1993) Postmarketing surveillance by patient self-monitoring: trazodone versus fluoxetine. Journal of Clinical Psychopharmacology. 13; 235-242.
4. Fisher S, Kent TA, Bryant SG. (1995) Postmarketing surveillance by patient self-monitoring: Preliminary data for Sertralina versus fluoxetine. Journal of Clinical Psychiatry. 56; 288-296.
5. Gelenberg AJ. (1992) Imperfect drugs in an imperfect world. Journal of Clinical Psychiatry. 53; 39-40.
6. Gelenberg AJ. (1995) "What will this drug do to me, doctor?" Journal of Clinical Psychiatry. 56; 00-00 [Personal communication, subsequently never published].
7. Gelenberg AJ, Schoonover SC. (1991) Depression. In Gelenberg AJ, Bassuk EL, Schoonover SC (Eds) The Practitioner's Guide to Psychoactive Drugs. (3rd edition) New York: Plenum. Pp.23-89.
RECONOCIMIENTOS
The Center for Medication Monitoring's postmarketing surveillance studies have been continuously supported by grants from the National Institute of Mental Health, the Hogg Foundation for Mental Health, and the University of Texas Medical Branch's institutional sources.
ANEXO 8
Introducción
1. A raíz de la Conferencia de Expertos sobre Uso Racional de los Medicamentos, celebrada en Nairobi en noviembre de 1985, la OMS preparó una estrategia revisada en materia de medicamentos que recibió el respaldo de la 39a Asamblea Mundial de la Salud en su resolución WHA39.27. Esa estrategia abarca, entre otros componentes, el establecimiento de criterios éticos para la promoción de medicamentos, que vienen a ser una actualización y ampliación de los criterios éticos y científicos establecidos en 1968 por la 21a Asamblea Mundial de la Salud en su resolución WHA21.41. Los criterios que siguen se han preparado en cumplimiento de lo que antecede, sobre la base de un proyecto que elaboró un grupo internacional de expertos.
Objetivo
2. El principal objetivo de los criterios éticos para la promoción de medicamentos consiste en apoyar y fomentar el mejoramiento de la atención sanitaria mediante el uso racional de los medicamentos.
Criterios éticos
3. La interpretación de lo que es ético varía según las regiones y las sociedades. En todas éstas la cuestión está en saber lo que constituye un comportamiento adecuado. Los criterios éticos para la promoción de medicamentos deben ofrecer una base indicativa del comportamiento adecuado en esa materia que sea compatible con la búsqueda de la verdad y la rectitud. Los criterios deben contribuir a decidir si las prácticas publicitarias relacionadas con los medicamentos son compatibles con normas éticas aceptables.
AÁmbito de aplicación de los criterios4. Estos criterios constituyen principios generales de normas éticas que pueden ser adapta
dos por los gobiernos a las circunstancias nacionales que correspondan a su situación política, económica, cultural, social, educativa, científica y técnica, a las leyes y los reglamentos, al perfil de la morbilidad, a las tradiciones terapéuticas y al grado de desarrollo de su sistema de salud. Los criterios son aplicables a los medicamentos vendidos tanto con receta como sin receta (medicamentosende venta libre). Se aplican igualmente, por lo general, a las medicinas tradicionales cuando proceda y a cualquier otro producto anunciado como medicina. Los criterios pueden ser utilizados por todo tipo de personas: gobiernos; industria farmacéutica (fabricantes y distribuidores); industria de la publicidad (agencias publicitarias, organizaciones de estudio de mercados, etc.); personal de salud participante en la prescripción, el despacho, el suministro y la distribución de medicamentos; universidades y otras instituciones docentes; asociaciones profesionales; grupos de pacientes y de consumidores; y medios informativos profesionales y generales (inclusive directores y editores de revistas de medicina y publicaciones afines). Se insta a todos ellos a que utilicen los criterios de manera apropiada en sus esferas de competencia, actividad y responsabilidad; se les recomienda igualmente que los tengan en cuenta al preparar sus propias normas éticas en su sector de actividad en relación con la promoción de medicamentos.
5. Los criterios no constituyen obligaciones legales; los gobiernos pueden adoptar leyes u otras medidas basadas en ellos cuando lo estimen oportuno. De igual modo, otros grupos pueden adoptar medidas de autorregulación basadas en ellos. Todas esas entidades deben vigilar y aplicar sus propias normas.
Promoción
6. En el presente contexto la "promoción" se refiere a todas las actividades informativas y de persuasión desplegadas por fabricantes y distribuidores con objeto de inducir a la prescripción, el suministro, la adquisición o la utilización de medicamentos.
7. La promoción activa dentro de un país debe limitarse a los medicamentos legalmente obtenibles en él. La promoción debe ser compatible con la política sanitaria nacional y estar en conformidad con los reglamentos nacionales así como con las normas libremente adoptadas donde existan. Toda la propaganda que contenga afirmaciones relativas a los medicamentos ha de ser fidedigna, exacta, verdadera, informativa, equilibrada, actualizada, susceptible de comprobación y de buen gusto. No debe contener declaraciones que se presten a una interpretación equívoca o que no puedan comprobarse, o bien omisiones que puedan inducir a la utilización de un fármaco que no esté médicamente justificado o que provoque riesgos indebidos. La palabra "inocuo" sólo debe emplearse cuando esté plenamente fundada. La comparación de productos ha de basarse en los hechos, y ser imparcial y susceptible de verificación. El material de propaganda no debe estar concebido de manera que oculte su verdadera naturaleza.
8. Los datos científicos del sector público deben ponerse a disposición de los encargados de recetar y de cualquier otra persona que tenga derecho a recibirlos y que los solicite, en la medida de sus necesidades. La promoción en forma de beneficios financieros o materiales no se extenderá al personal de salud ni será recabada por éste, ya que podría influir en la prescripción de medicamentos.
9. Las actividades científicas y educativas no deben utilizarse deliberadamente con fines de propaganda.
Publicidad
a) Publicidad de todo tipo destinada a médicos y profesionales relacionados con la salud
10. El texto y las ilustraciones de los anuncios destinados a los médicos y profesionales de la salud deben ser enteramente compatibles con la hoja de datos científicos aprobada para el medicamento de que se trate o con cualquier otra fuente de información de contenido análogo. El texto ha de ser enteramente legible.
11. Algunos países exigen que los anuncios contengan información completa sobre el producto, de acuerdo con la hoja de datos científicos aprobada o un documento análogo, para un periodo determinado a partir de la fecha del primer anuncio o para toda la duración del producto. Los anuncios basados en un reclamo publicitario deben contener por lo menos información científica resumida.
12. La lista siguiente, basada en la hoja de datos sobre medicamentos que figura en el segundo informe del Comité de Expertos de la OMS en Uso de Medicamentos Esenciales1 (de la cual se adjunta una copia, como apéndice), puede servir como ejemplo del tipo de información que esos anuncios deben generalmente contener:
‑el (los) nombre(s) del (de los) ingrediente(s) activo(s) utilizando la denominación común internacional (DCI) o el nombre genérico aprobado del medicamento;
‑el nombre comercial;
‑contenido de (de los) ingrediente(s) por forma farmacéutica o régimen;
‑nombre de otros ingredientes que se sabe pueden causar problemas;
‑usos terapéuticos aprobados;
‑forma farmacéutica o régimen;
‑efectos secundarios y principales reacciones adversas;
‑precauciones, contraindicaciones y advertencias;
‑principales interacciones;
‑el nombre y la dirección del fabricante o distribuidor;
‑referencia a documentación científica, si procede.
13. Cuando se permiten los anuncios sin reclamo publicitario (anuncios recordativos), deben incluir por lo menos el nombre comercial, la denominación común internacional o el nombre genérico aprobado, el nombre de cada ingrediente activo y el nombre y la dirección del fabricante o distribuidor para poder recibir información complementaria.
b) Publicidad de todo tipo para el público en general
14. Los anuncios dirigidos al público en general deben contribuir a que la población pueda tomar decisiones racionales sobre la utilización de medicamentos que están legalmente disponibles sin receta. Aun teniendo en cuenta el deseo legítimo de la gente de obtener información de interés para su salud, en ellos no se debe aprovechar indebidamente la preocupación de la población a ese respecto. Por lo general, no deben permitirse para los medicamentos vendidos con receta o para anunciar medicamentos destinados a ciertas afecciones graves que sólo pueden ser tratadas por personal de salud competente, y sobre los cuales algunos países han preparado listas. Para combatir la toxicomanía y la farmacodependencia, no se hará publicidad entre el público en general de los estupefacientes y de los medicamentos psicotrópicos que son objeto de fiscalización. Aunque es muy conveniente la educación sanitaria entre los niños, los anuncios no deben estar dirigidos a ellos. En los anuncios se afirmará que un medicamento puede curar, evitar o aliviar una dolencia sólo si esto puede comprobarse. Deben también indicar, cuando proceda, las limitaciones apropiadas en el uso del medicamento.
15. Cuando se utiliza un lenguaje no técnico, la información ha de ajustarse a la hoja de datos científicos aprobada o tener una base científica legalmente determinada para su aprobación. No debe emplearse un lenguaje que provoque miedo o angustia.
16. La lista siguiente es un ejemplo del tipo de información que deben contener los anuncios destinados al público en general, habida cuenta del medio informativo utilizado:
‑el (los) nombre(s) del (de los) ingrediente(s) activo(s) utilizando la denominación común internacional (DCI) o el nombre genérico aprobado del medicamento;
‑el nombre comercial;
‑principales indicaciones para su uso;
‑principales precauciones, contraindicaciones y advertencias;
‑el nombre y la dirección del fabricante o distribuidor.
La información sobre el precio para el consumidor debe figurar de manera exacta y veraz.
Representantes de productos farmacéuticos
17. Los representantes de productos farmacéuticos han de tener una formación apropiada y recibir un adiestramiento adecuado. Deben poseer conocimientos médicos y técnicos suficientes y la integridad necesaria para presentar información sobre productos y llevar a cabo otras actividades de promoción de una manera correcta y responsable. Los empleadores son responsables de la formación básica y continua de sus representantes. Esa formación debe comprender instrucción relativa a la conducta ética apropiada teniendo en cuenta los criterios de la OMS. En este contexto, puede ser muy útil que los representantes de productos farmacéuticos y quienes quieran dedicarse a esa profesión reciban información, sobre todo acerca de los riesgos, de la profesión médica y otras profesiones, así como de miembros independientes de la población.
18. Los representantes de productos farmacéuticos deben poner a la disposición de las personas encargadas de recetar o despachar medicinas una información completa e imparcial para cada producto de que se trate, tal como una hoja de datos científicos aprobada o cualquier otra fuente de información de contenido análogo.
19. Los empleadores han de ser responsables de las declaraciones y actividades de sus representantes de productos farmacéuticos. Los representantes no deben ofrecer incentivos a las personas encargadas de recetar o despachar medicinas. Las personas encargadas de recetar o despachar medicinas no deben solicitar dichos incentivos. Con objeto de evitar una promoción excesiva, la parte principal de la remuneración de los representantes de productos farmacéuticos no debe estar directamente relacionada con el volumen de sus ventas.
Muestras gratuitas para promoción de medicamentos vendidos con receta
20. Podrán entregarse pequeñas cantidades de muestras gratuitas de medicamentos vendidos con receta legalmente disponibles, previa solicitud, a las personas encargadas del sector.
Muestras gratuitas para promoción entre el público en general de medicamentos vendidos sin receta
21. Las actitudes varían en lo que respecta a la distribución de muestras gratuitas para promover entre el público medicamentos vendidos sin receta; algunos países lo permiten y otros no. Hay que distinguir además entre la distribución gratuita por organismos de salud para tratar a ciertos grupos y la distribución entre el público en general con fines de promoción; esta última es difícil de justificar desde el punto de vista medicosanitario. Si esa práctica es legal en algún país, conviene adoptar medidas muy restrictivas.
Simposios y otras reuniones científicas
22. Los simposios son útiles para difundir información. El contenido científico objetivo de esas reuniones debe ser lo primordial y con ese fin pueden ser útiles las comunicaciones presentadas por científicos y profesionales de la salud independientes. Su valor educativo será sin duda mayor si están organizados por entidades científicas o profesionales.
23. El patrocinio por un fabricante o distribuidor de productos farmacéuticos debe anunciarse claramente de antemano en la reunión y en todas las actas. Estas últimas deben reflejar con exactitud las comunicaciones y los debates. Los agasajos y cualquier otro gesto de hospitalidad, así como los regalos ofrecidos a los miembros de las profesiones médicas y afines, deben ocupar un lugar secundario con respecto al objetivo principal de la reunión y han de mantenerse en un nivel modesto.
24. Cualquier apoyo a profesionales de la salud individuales para participar en un simposio nacional o internacional no debe estar condicionado a la obligación de anunciar ningún producto medicinal.
Estudios científicos, vigilancia y difusión de informaciones ulteriores a la comercialización
25. Después de la comercialización, los ensayos clínicos de medicamentos aprobados son importantes para garantizar su uso racional. Se recomienda que se comunique a las autoridades sanitarias nacionales competentes la realización de cualquiera de esos estudios y que comités científicos y éticos competentes confirmen la validez de los protocolos de investigación. Puede ser muy útil la cooperación interpaíses y regional en esos estudios. La información comprobaba sobre dichos estudios debe notificarse a las autoridades sanitarias nacionales competentes y ser difundida lo antes posible.
26. Los estudios científicos y la vigilancia ulteriores a la comercialización no deben usarse indebidamente como una forma de promoción encubierta.
27. La información comprobada sobre los riesgos asociados a los medicamentos ha de ponerse en conocimiento de las autoridades sanitarias nacionales competentes con carácter prioritario y debe difundirse internacionalmente lo antes posible.
Envasado y rotulación
28. Dado que la información apropiada es importante para un uso racional de los medicamentos, todo el material de envasado y rotulación debe contener datos compatibles con lo aprobado por los organismos nacionales de reglamentación farmacéutica. Donde no exista dicho organismo o sea rudimentario, ese material ha de contener información compatible con la aprobada por los organismos de reglamentación farmacéutica del país del que el medicamento ha sido importado, o de otras fuentes fidedignas de información con contenido análogo. Los textos y las ilustraciones de los envases y las etiquetas deben ajustarse a los principios de los criterios éticos enunciados en el presente documento.
Información para los pacientes: prospectos, folletos y otras instrucciones impresas
29. Es preciso que los pacientes dispongan de una información adecuada sobre el uso de los medicamentos. Siempre que sea posible, la información de esa índole debe estar a cargo de médicos o de farmacéuticos. Cuando los gobiernos exigen prospectos o folletos, los fabricantes o distribuidores han de cerciorarse de que contienen únicamente la información que ha sido aprobada por los organismos nacionales de reglamentación farmacéutica. Si los prospectos o folletos se utilizan con fines de propaganda deben ajustarse a los criterios éticos enunciados en el presente documento. El texto de los prospectos contenidos en el envase o de los folletos, si se destina específicamente a los pacientes, debe estar redactado en lenguaje corriente a condición de que se refleje adecuadamente el contenido médico y científico.
30. Además de los prospectos y folletos aprobados, se debe fomentar cuando convenga la preparación y distribución de folletos y de otro material informativo para pacientes y consumidores. El material de esa índole debe igualmente ajustarse a los criterios éticos enunciados en el presente documento.
Promoción de medicamentos exportados
31. Los criterios éticos para la promoción de medicamentos exportados deben ser idénticos a los que se apliquen en el país exportador. Es conveniente que los países exportadores y los importadores que todavía no lo hagan utilicen el Sistema OMS de certificación de la calidad de los productos farmacéuticos objeto de comercio internacional.
Apéndice
Hoja modelo de datos sobre medicamentos1
Hojas de datos sobre medicamentos
Para lograr que los medicamentos resulten inocuos y eficaces, quienes los recetan y consumen necesitan varios tipos de datos. La lista que figura a continuación es un modelo que se adaptará a las necesidades y a las aptitudes de la persona encargada de recetar el producto.
1) Denominación Común Internacional (DCI) de cada sustancia activa.
2) Características farmacológicas: breve descripción de los efectos farmacológicos y del mecanismo de acción.
3) Información clínica:
a) Indicaciones: consignación de criterios sencillos de diagnóstico, cuando proceda.
b) Posología y datos farmacocinéticos pertinentes:
‑ dosis media y dosis máxima y mínima para adultos y niños;
‑ intervalo entre las dosis;
‑ duración media del tratamiento;
‑ casos particulares (por ejemplo, insuficiencias renales, hepáticas o cardiacas, o carencias nutricionales que imponen una dosis superior o inferior).
c) Contraindicaciones.
d) Precauciones y advertencias (en relación con el embarazo, la lactancia, etc.).
e) Efectos adversos (de ser posible, indicación cuantitativa por categoría).
f) Interacción de varios medicamentos (sólo si resulta clínicamente pertinente; incluir los productos que se empleen en la automedicación).
g) Dosis excesivas:
‑ breve descripción clínica de los síntomas;
‑ tratamiento no medicamentoso y terapia de apoyo;
‑ antídotos específicos.
4) Información farmacéutica:
a) Formas de administración.
b) Actividad de la forma farmacéutica.
c) Excipientes.
d) Condiciones de almacenamiento y fecha de caducidad.
e) Tamaño de los envases.
f) Descripción del producto y forma del envase.
g) Categoría legal (estupefaciente u otro fármaco fiscalizado, venta con receta o venta libre).
h) Nombre y dirección de fabricante(s) e importador(es).
1OMS, Serie de Informes Téc
hnicos No 722, 1985, p. 47.
[1] APM: Agentes de Propaganda Médica, tradicionalmente “visitadores médicos”, “valijas” en la jerga médica o “rep” en inglés.
[2] Basado en Gonzalez Garcia, G. “Remedios Políticos para los Medicamentos”, Cap. 1 Ed. Isalud1994
[3] Tomado de Conceptos básicos de psicofarmacología. Bajado de htpp://psicofarmacologia.bizland.com
[4] Clarín Económico, 15/04/01, pag. 7
[5] De www.ILADIBA.com
[6] Clarín Económico, 27/12/00, pag. 23
[7] http://www.ims-global.com/insight/news_story/0103/news_story_010314.htm
[8] Guia del mundo 1996-1997: El mundo visto desde el sur, Ed. Lumen, Montevideo, Uruguay
[9] Clarín Económico 22/04/01, pag. 16.
[10] Sonis A. Equidad y Salud, en Medicina y Sociedad, Vol 23, No 4, 2000 224-228
[11] www.valija.com
[12] IMS HEALTH Pharma Prognosis Latin America, 2000-2004
[13] El término bioequivalencia se refiere a la velocidad y proporción en que el mismo principio activo de dos medicamentos «iguales» alcanza la circulación sistémica. Por ello, la bioequivalencia se cuantifica mediante la determinación de los niveles plasmáticos del fármaco contenido en los dos medicamentos (biodisponibilidad). El estudio suele ser cruzado y consiste en la administración de una sola dosis de cada formulación a un grupo de voluntarios sanos; a veces, dependiendo de las propiedades farmacocinéticas del principio activo, se requieren múltiples dosis o estudios en el equilibrio estacionario.
[14] www.isalud.org
[15] Callejón M y Ortún Rubio V. “Los medicamentos en España...” citado en Gonzalez García G. op. cit.
[16] Boletín Fármacos Nro 37
[17] Según la legislación española, Especialidad Farmacéutica Genérica es "La especialidad con la misma forma farmacéutica e igual composición cualitativa y cuantitativa en sustancias medicinales que otra especialidad de referencia, cuyo perfil de eficacia y seguridad esté suficientemente establecido por su continuado uso clínico. La especialidad farmacéutica genérica debe demostrar la equivalencia terapéutica con la especialidad de referencia mediante los correspondientes estudios de bioequivalencia. Las diferentes formas farmacéuticas orales de liberación inmediata podrán considerarse la misma forma farmacéutica siempre que hayan demostrado su bioequivalencia" . Se trata de los denominados "genéricos" que son medicamentos "iguales" -bioequivalentes- a los medicamentos de marca, que han superado estrictos controles de calidad para su aprobación y comercialización, suponiendo en algunos casos ventajas económicas importantes al estar liberados de determinados costes secundarios inherentes a la investigación de la molécula original". Como he mencionado, en Argentina no se realizan controles de bioequivalencia, por lo que se suelen llamar “copias” a los medicamentos con igual droga que el titular de la patente.
[18] Archives of Internal Medicine, 160(9):2799-2803, Oct 2000
[19] Friedberg M, Saffran B, Stinson T, Nelson W, Bennett C. Evaluation of conflict of interest in economic analyses of new drugs used in oncology. JAMA 1999; 282 (15): 1453-1457.
[20] Revista del Sur 80/Laboratorios/Chetley.htm
[21] Lancet 1996; 347 (9015): 1628-1629
[22] Randel T. Kennedy Hearings say no more free lunch-or much else-from drug firms. Ethics of receiving gifts considered. Does advertising influence physicians? JAMA 1991; 265: 4: 440-442